
- •Техническая термодинамика
- •Внутренняя энергия и энтальпия тела как функции состояния
- •Дросселирование. Эффект Джоуля-Томпсона.
- •Реальный газ и уравнения состояния реального газа. Опыты Эндрюса. Критическая точка. Уравнение Ван-дер-Ваальса.
- •Пары. Испарение. Кипение.
- •Условие устойчивости и равновесие в изолированной однородной системе
- •Термические и калорические свойства жидкостей
- •Регенеративный цикл
Техническая термодинамика
Под нормальными физическими условиями понимаются следующие параметры: давление 760 мм. рт. ст. и температура 0ºС.
Соотношения шкал температур:
![]() ,
где T – температура
в градусах Цельсия,
,
где T – температура
в градусах Цельсия,
![]() – в градусах Ренкина,
– в градусах Ренкина,
![]() – Фаренгейта,
– Фаренгейта,
![]() – Реамюра,
– Реамюра,
![]() – Кельвина.
– Кельвина.
Соотношения шкал давлений:
![]() .
.
Удельный объём
![]() ,
где
– плотность.
,
где
– плотность.
Термодинамической системой называется совокупность материальных тел, взаимодействующих как между собой, так и с окружающей средой. Если хотя бы один из параметров изменяется, то изменяется и состояние системы, т.е. осуществляется термодинамический процесс.
Типы процессов: изотермический
![]() (Бойля-Мариотта), изобарический
(Бойля-Мариотта), изобарический
![]() (Гей-Люссака), изохорический
(Гей-Люссака), изохорический
![]() (Шарля), адиабатический
(Шарля), адиабатический
![]() ,
политропный
,
политропный
![]() .
.
Закон Менделеева-Клапейрона:
![]() ,
где
,
где
![]() – количество молей вещества, m
– масса газа, M –молярная
масса,
– количество молей вещества, m
– масса газа, M –молярная
масса,
![]() – универсальная газовая постоянная.
– универсальная газовая постоянная.
Чистое вещество – такое вещество, в котором все молекулы одинаковы.
Смесь, состоящая из нескольких чистых веществ называется раствором.
Массовая доля i-го
компонента раствора
![]() ,
где m – масса раствора;
объёмная доля
,
где m – масса раствора;
объёмная доля
![]() ,
где
,
где
![]() – молярная доля i-го
компонента.
– молярная доля i-го
компонента.
![]() .
Давление смеси
.
Давление смеси
![]() ,
где
,
где
![]() – давление i-го
компонента (парциальное давление),
– давление i-го
компонента (парциальное давление),
![]() .
Кажущаяся молярная масса
.
Кажущаяся молярная масса
![]() .
.
Теплоёмкость вещества – количество тепла, необходимая для нагрева его на 1 К.
Истинная теплоёмкость –
теплоёмкость при данной температуре
![]() .
.
Удельная теплоёмкость
вещества
![]() .
.
Средняя теплоёмкость
![]() .
.
![]() ,
где
,
где
![]() – объёмная теплоёмкость,
– объёмная теплоёмкость,
![]() ,
где
,
где
![]() – молярная теплоёмкость,
– молярная теплоёмкость,
![]()
![]() ,
здесь V – объём при
нормальных температуре и давлении.
,
здесь V – объём при
нормальных температуре и давлении.
Внутренняя энергия и энтальпия тела как функции состояния
Внутренняя энергия тела складывается из поступательного и вращательного движения молекул, потенциальной энергии связей молекул, энергии колебаний молекул, внутриатомной и внутриядерной энергий. Внутренняя энергия обладает экстенсивным свойством, т.е. зависит от массы тела.
Энтальпия
![]() ,
где U
– внутренняя энергия. Удельная энтальпия,
соответственно,
,
где U
– внутренняя энергия. Удельная энтальпия,
соответственно,
![]() .
.
I закон термодинамики:
![]() или
или
![]() ,
где Q
и q
– обычное и удельное тепло, U
и u
= обычная и удельная внутренняя энергия,
,
где Q
и q
– обычное и удельное тепло, U
и u
= обычная и удельная внутренняя энергия,
![]() и
и
![]() – обычная и удельная работа при переходе
из первого состояние во второе. В
дифференциальной форме:
– обычная и удельная работа при переходе
из первого состояние во второе. В
дифференциальной форме:
![]() (здесь используется символ «»,
т.к. тепло зависит также от способа его
передачи, т.е. выражение справа не
является полным дифференциалом тепла).
Т.к.
(здесь используется символ «»,
т.к. тепло зависит также от способа его
передачи, т.е. выражение справа не
является полным дифференциалом тепла).
Т.к.
![]() ,
то
,
то
![]() (здесь
(здесь
![]() выступает в роли технической работы,
т.е. работа, совершённая оборудованием).
выступает в роли технической работы,
т.е. работа, совершённая оборудованием).
В случае изотермического процесса
теплоёмкость
![]() ,
изобарного:
,
изобарного:
![]()
![]() .
.
Другая формулировка I закона термодинамики: Энергия изолированной термодинамической системы остаётся неизменной независимо от того, какие процессы в ней протекают.
Р ассмотрим
первый закон термодинамики в применении
к движущемуся потоку. Для этого возьмём
произвольный канал, по которому движется
газ. Возьмём два сечения канала. Пусть
площади их соответственно
ассмотрим
первый закон термодинамики в применении
к движущемуся потоку. Для этого возьмём
произвольный канал, по которому движется
газ. Возьмём два сечения канала. Пусть
площади их соответственно
![]() и
и
![]() ,
высота над землёй
,
высота над землёй
![]() и
и
![]() ,
скорость входящего потока
,
скорость входящего потока
![]() ,
выходящего
,
выходящего
![]() ,
среднее по сечению давление
,
среднее по сечению давление
![]() и
и
![]() .
.
Рассмотрим изменения энергии: удельная
работа проталкивания вещества сквозь
канал
![]() ;
изменение удельной кинетической энергии
;
изменение удельной кинетической энергии
![]() ;
изменение удельной потенциальной
энергии:
;
изменение удельной потенциальной
энергии:
![]() ,
удельная работа трения:
,
удельная работа трения:
![]() ,
удельная полезная работа:
,
удельная полезная работа:
![]() .
Тогда суммарная удельная работа
.
Тогда суммарная удельная работа
![]() ,
изменение суммарной удельной работа
,
изменение суммарной удельной работа
![]() и I-й закон термодинамики
выглядит так:
и I-й закон термодинамики
выглядит так:
![]() .
При этом
.
При этом
![]() ,
где
,
где
![]() – тепло, получающееся за счёт трения,
– тепло, получающееся за счёт трения,
![]() – внешний нагрев. Тогда
– внешний нагрев. Тогда
![]() .
Если
.
Если
![]() ,
то
,
то
![]() .
Если процесс адиабатический (
.
Если процесс адиабатический (![]() ,
т.е.
,
т.е.
![]() ),
то
),
то
![]() и
и
 .
.
Функция
![]() является полным дифференциалом, т.е.
является функцией состояния системы и
называется энтропией (здесь – удельной).
В случае обратимых процессов
является полным дифференциалом, т.е.
является функцией состояния системы и
называется энтропией (здесь – удельной).
В случае обратимых процессов
![]() ,
необратимых –
,
необратимых –
![]() .
Энтропия является мерой неупорядоченности
системы.
.
Энтропия является мерой неупорядоченности
системы.
![]() .
Аналогично
.
Аналогично
![]()
![]() .
.
Схема работы теплового двигателя
![]()
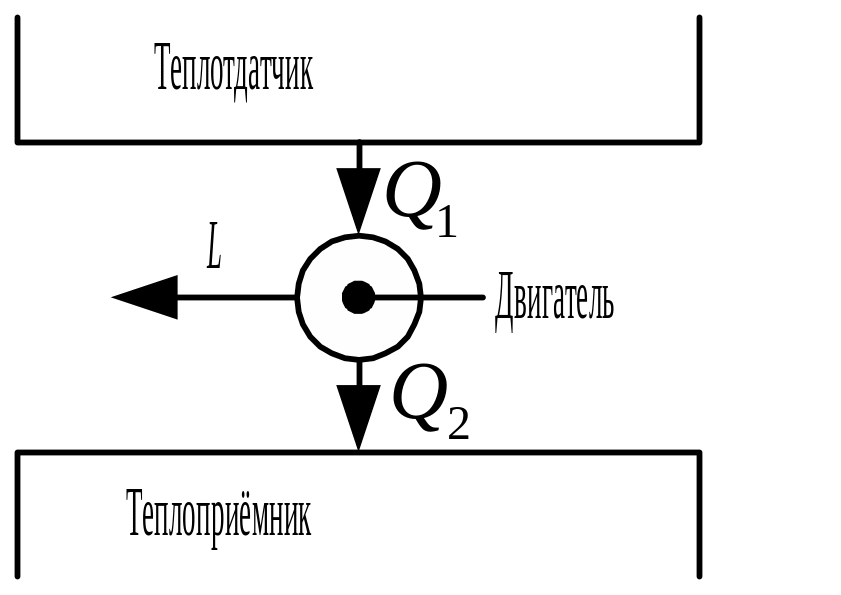
 –
уравнение теплового баланса в двигателях.
–
уравнение теплового баланса в двигателях.
КПД теплового двигателя
![]() .
.
Пусть у теплоприёмника и теплоотдатчика поддерживаются постоянные температуры и . Рассмотрим цикл двух изотерм и двух адиабат (Цикл Карно):
![]() .
.
Теорема Карно: Значение КПД для цикла Карно определяется исключительно температурами теплоотдатчика и теплоприёмника независимо от рода рабочего тела, размеров двигателя и конструктивных особенностей.
Термодинамической вероятностью называют число микросостояний, результирующих данное макросостояние.
Энтропия
![]() ,
где k – постоянная
Больцмана, W –
термодинамическая вероятность.
,
где k – постоянная
Больцмана, W –
термодинамическая вероятность.
Изопроцессы
И зотермический
процесс:
зотермический
процесс:
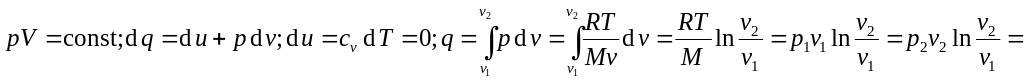
![]() .
.
Изобарный процесс:

![]() (здесь q – техническая
работа);
(здесь q – техническая
работа);
![]()
![]() .
.
Изохорный процесс:
![]() .
.
Адиабатический процесс:
![]() ;
в течение
какого-то процесса может, вообще говоря,
меняться, например, при изменении
агрегатного состояния рабочего вещества
(перегретый пар
насыщенный пар
обычный пар).
;
в течение
какого-то процесса может, вообще говоря,
меняться, например, при изменении
агрегатного состояния рабочего вещества
(перегретый пар
насыщенный пар
обычный пар).
С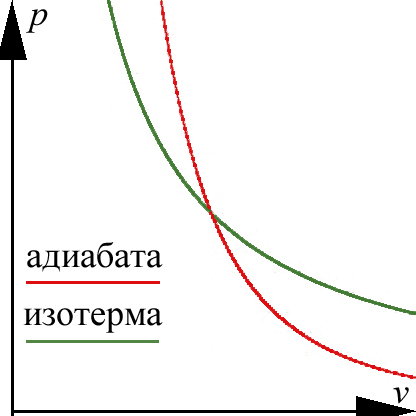 остояние
системы описывается уравнениями:
остояние
системы описывается уравнениями:
![]() .
.

Политропный процесс:
![]() .
При
.
При
![]() он переходит в изобарный процесс, при
он переходит в изобарный процесс, при
![]() – изотермический,
– изотермический,
![]() – адиабатический,
– адиабатический,
![]() – изохорный (здесь уравнение удобно
представлять в виде
– изохорный (здесь уравнение удобно
представлять в виде
![]() ).
).
![]() ,
где
,
где
![]()
![]() .
.
Дифференциальные уравнения термодинамики. Основные математические методы.
Уравнения Максвелла
Первый закон термодинамики гласит, что
![]() .
Пусть x и y
– термодинамические параметры, т.е.
.
Пусть x и y
– термодинамические параметры, т.е.
![]() .
Тогда
.
Тогда
![]() .
Аналогично и для y.
.
Аналогично и для y.
![]()
![]() ,
,
![]() .
Т.к. все используемые функции у нас
считаются непрерывными, то
.
Т.к. все используемые функции у нас
считаются непрерывными, то
![]() ,
где
,
где
![]() .
Тогда, т.к.
.
Тогда, т.к.
![]() ,
то
,
то
![]() или
или
![]() .
Начнём перебирать x
и y. Заметим, что,
например,
.
Начнём перебирать x
и y. Заметим, что,
например,
![]() и
и
![]() .
В результате получаются четыре уравнения
Максвелла:
.
В результате получаются четыре уравнения
Максвелла:
![]()
![]() .
.
Частные производные внутренней энергии и энтальпии
![]() (согласно одному из уравнений Максвелла)
(согласно одному из уравнений Максвелла)
![]() – характеризует зависимость внутренней
энергии от удельного объёма в изотермическом
процессе.
– характеризует зависимость внутренней
энергии от удельного объёма в изотермическом
процессе.
![]() – зависимость энтальпии от давления в
изотермическом процессе.
– зависимость энтальпии от давления в
изотермическом процессе.
Обратимость и производство работы
Будем рассматривать изолированную систему с источником работы. Производство работы изолированной системой возможно в процессе перехода системы из неравновесного состояния в равновесное, причём величина работы зависит от характера процесса перехода.
Пусть
![]() – параметры окружающей среды (которая
тоже входит в изолированную систему),
p и T
– параметры источника работы и пусть
– параметры окружающей среды (которая
тоже входит в изолированную систему),
p и T
– параметры источника работы и пусть
![]() .
Пусть также внутренняя энергия и объём
источника работы в начале процесса есть
.
Пусть также внутренняя энергия и объём
источника работы в начале процесса есть
![]() и
и
![]() ,
в конце –
,
в конце –
![]() и
и
![]() ,
окружающей среды в начале
,
окружающей среды в начале
![]() и
и
![]() ,
в конце –
,
в конце –
![]() и
и
![]() .
Тогда работа, совершённая в системе
.
Тогда работа, совершённая в системе
![]() .
Пусть
.
Пусть
![]() – это количество тепла, которое источник
работы передал окружающей среде,
– это количество тепла, которое источник
работы передал окружающей среде,
![]() – работа, совершаема источником над
окружающей средой. Тогда
– работа, совершаема источником над
окружающей средой. Тогда
![]() .
Т.к.
.
Т.к.
![]() ,
то
,
то
![]() или
или
![]() .
Это уравнение даёт значение полезной
работы, произведённой системой при
переходе из неравновесного состояния
в равновесное, т.к. из всей произведённой
работы
.
Это уравнение даёт значение полезной
работы, произведённой системой при
переходе из неравновесного состояния
в равновесное, т.к. из всей произведённой
работы
![]() вычитается та её часть, которая
затрачивается на сжатие среды, а,
следовательно, не может быть использована
в наших целях. Однако это уравнение не
даёт максимальную величину полезной
работы, т.к. не обуславливает обязательной
обратимости всех происходящих в системе
процессов. Для нахождение максимальной
полезной работы (работоспособности)
можно воспользоваться тем, что при
протекании обратимых процессов энтропия
системы не изменяется, т.е.
вычитается та её часть, которая
затрачивается на сжатие среды, а,
следовательно, не может быть использована
в наших целях. Однако это уравнение не
даёт максимальную величину полезной
работы, т.к. не обуславливает обязательной
обратимости всех происходящих в системе
процессов. Для нахождение максимальной
полезной работы (работоспособности)
можно воспользоваться тем, что при
протекании обратимых процессов энтропия
системы не изменяется, т.е.
![]() .
Максимальная полезная работа
.
Максимальная полезная работа
![]() .
Удельная максимальная
полезная работа называется эксергией.
Обозначение: ex.
.
Удельная максимальная
полезная работа называется эксергией.
Обозначение: ex.
![]() .
Потеря работоспособности
.
Потеря работоспособности
![]() ,
где
,
где
![]() – полезная работа. Также эта величина
называется энергетической потерей.
– полезная работа. Также эта величина
называется энергетической потерей.
