
- •Общая химия Сборник методических материалов
- •Киров - 2004
- •Решение
- •Раствор
- •Расчеты в объемном анализе
- •Основные расчетные формулы
- •Погрешности анализа и точность вычислений
- •Метод нейтрализации
- •Перманганатометрия
- •Примеры решения типовых задач
- •Примеры решения типовых задач.
- •Контрольные вопросы для самопроверки
- •Учение о растворах
- •Примеры решения типовых задач
- •Программа контрольной работы n 1
- •I. Термодинамика
- •II. Химическая кинетика и химическое равновесие
- •III. Коллигативные свойства растворов
- •Контрольные вопросы для самопроверки
- •Примеры решения типовых задач Используемые обозначения и размерности
- •Основные расчетные формулы
- •Вопросы для самопроверки
- •Тема. Буферные системы
- •Примеры решения типовых задач
- •Задача 2. Вычисление произведения растворимости
- •Разделы, выносимые на самостоятельную подготовку: 1) номенклатура комплексных соединений, 2) геометрия комплексных соединений.
- •Письменнное задание к занятию № 1.
- •Задания 1 и 2 выполните в виде таблицы по образцу
- •Тема: Биогенные элементы
- •Азот - макробиогенный элемент
- •Ситуационные задачи
- •Приложение
- •Термодинамические константы веществ
- •Стандартные ов-потенциалы в водных растворах
- •Константы нестойкости некоторых комплексных ионов
- •Произведения растворимости некоторых малорастворимых электролитов при 250с
- •Константы диссоциации слабых электролитов в водных растворах 298 к
- •Основные понятия термодинамики
- •2 Начало термодинамики
- •Буферные растворы
- •Окислительно-восстановительные процессы
- •Оглавление
- •Буферные системы …………………………………………………………………...... 46
Расчеты в объемном анализе
Основаны на законе эквивалентов:
в химических реакциях вещества реагируют между собой в эквивалентных количествах:
А + В = С + Д
nА = nВ = nC = nД
вещества реагируют между собой в массовых количествах, пропорциональных их
эквивалентам
![]()
Выразим число эквивалентов через молярную концентрацию эквивалента:
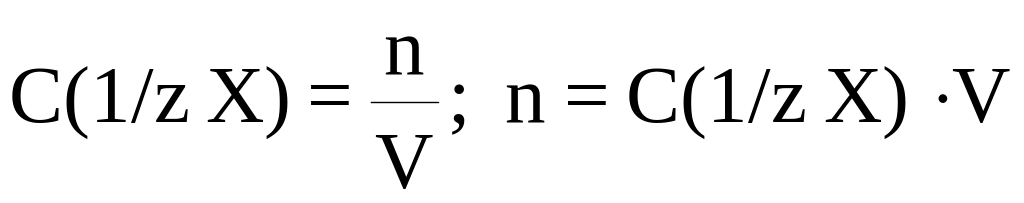 ,
тогда закон эквивалентов примет вид:
,
тогда закон эквивалентов примет вид:
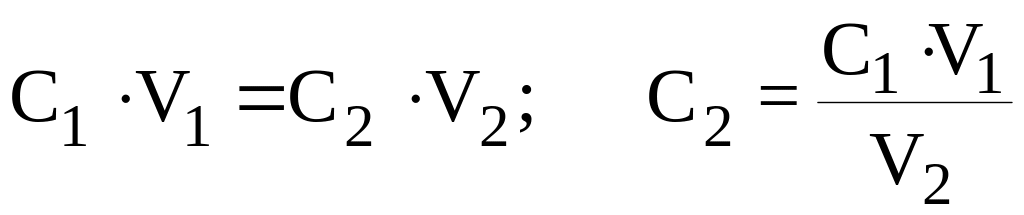 основная расчетная формула.
основная расчетная формула.
Основные расчетные формулы
При вычислении используются следующие обозначения и единицы измерения:
Т – титр раствора, г/мл;
m – масса вещества в растворе, г;
V – объем раствора, мл;
С(1/z X) – молярная концентрация эквивалента (нормальная концентрация), моль/л;
1/z·M(X) – молярная масса эквивалента, г/моль;
n – число моль эквивалентов.
![]()
![]()
![]()
![]()
Погрешности анализа и точность вычислений
Погрешностью измерения называют отклонение результата измерения от истинного значения измеряемой величины.
Погрешность анализа равна Δx = (xэксп – xист), где Δx – абсолютная погрешнось; xэксп результат анализа; xист – истинное содержание анализируемого компонента в пробе.
Относительной погрешностью измерения называется отношение абсолютной погрешности к истинному значению измеряемой величины
![]()
Систематической погрешностью называют постоянную по знаку и величине погрешность измерения. Систематическая погрешность или только занижает или только завышает результат. Её можно предусмотреть или устранить.
Погрешности, которые изменяются при повторных измерениях случайным образом, называются случайными. Их нельзя устранить, можно только уменьшить, увеличив число параллельных измерений.
Грубые погрешности, искажающие результат, называют промахами (разлив раствора, просыпание навески и т.п.).
При выполнении расчётов следует учитывать следующие математические правила. Результат анализа приближённое число, содержащее несколько цифр. Количество цифр определяется целями анализа. Если точность анализа не оговаривается заранее, то следует иметь в виду, что концентрация вычисляется до четвёртой значащей цифры после запятой, масса до четвёртого знака после запятой, процентное содержание (массовая доля) до сотых долей.
Значащими цифрами являются все цифры, отличные от нуля. Сам нуль является значащим, если он расположен между значащими цифрами или после них. Например, в числах 5,2304 и 1,3710 нули значимы, а в числе 0,0643 незначимы.
Каждый результат не может быть точнее, чем это позволяют измерительные приборы, и математическими расчётами точность анализа повысить нельзя. Лишние цифры рекомендуется округлять по следующим правилам.
1. Если последняя цифра 4, то её отбрасывают, а если она > 5, то прибавляют единицу к предыдущей цифре. Когда последняя цифра 5, то её отбрасывают, если перед ней стоит чётная цифра; и прибавляют единицу к предыдущей цифре, если она нечётная. Непример, 12,465 12,46 но 12,475 12,48.
2. При сложении и вычитании приближённых чисел необходимо в результате сохранять столько десятичных знаков, сколько их содержится в числе с наименьшим числом десятичных знаков. Например, если складывают числа: 39,102; 186,2071; 63,9976, результат должен иметь три десятичных знака (289,307).
3. При умножении и делении в результате надо сохранять столько цифр, сколько требуется для данной измеряемой величины. Например, при вычислении массы по формуле: m=ТV, несмотря на то, что объёмы измеряют до сотых долей, результат должен содержать четыре значащие цифры.
4. В промежуточных подсчётах следует брать результат на одну цифру больше, чем рекомендуют правила. В конечном результате эту цифру округляют.
Примеры решения типовых задач.
Задача 1. Какова молярная концентрация эквивалента раствора HCl, если на титрование 10,00 мл его расходуется 12,50 мл 0,08000 н. раствора KOH?
Решение: используем формулу C1.V1 = C2V2 ;
![]() моль/л
моль/л
Задача 2. Чему равен титр 0,05000 н. раствора H2SO4?
Решение:
по формуле
![]()
Т
=
![]() г/мл.
г/мл.
Задача 3. Сколько моль эквивалентов содержится в 800,0 мл 0,1500 н. раствора?
Решение: число моль эквивалентов может быть найдено по одной из формул:
![]()
В
нашем случае возможно вычисление:
![]()
Задача 4. Сколько граммов Na2CO3 содержится в 450,0 мл 0,08000 н. раствора?
Решение:
используем формулу:
![]() ;
;
![]()
Задача 5. Сколько граммов KOH содержится в растворе, если на его титрование расходуется 21,35 мл 0,2000 н. раствора HCl?
Решение:
т.к. n(KOH)
= n(HCl),
то m(KOH)
= n(HCl)
·1/z·M(КОН)
= =![]()
Задача 6. Какова молярная концентрация эквивалента, если фиксанал «0,05 эквивалента» HCl растворён в мерной колбе объемом 500,0 мл?
Решение:
используем
формулу
![]() ,
откуда
,
откуда
![]()
Тема: Кислотно-основное титрование (метод нейтрализации).
Домашнее задание для подготовки к занятию. Выучите расчётные формулы и правила титрования. Письменно решите задачи:
1.Сколько граммов HNO3 содержится в 500 мл раствора, если титр его равен 0,006302 г/мл? (Ответ: 3,151 г).
2.Титр раствора HCl равен 0,003600 г/мл. Вычислите его молярную концентрацию эквивалента. (Ответ: 0,09874).
3. На титрование 20,00 мл раствора HNO3 затрачено 15,00 мл 0,1236 н раствора NaOH. Вычислите молярную концентрацию эквивалента, титр и массу HNO3 в 250 мл раствора. (Ответ: С = 0,09764; Т = 0,006154 г/мл, m = 1,5384 г).
4.Какой объем 0,1586 н раствора NaOH пойдет на титрование:
а) 21,00 мл 0,1133 раствора HCl; б) 21,00 мл раствора HCl с титром 0,00381?
(Ответ: а) 15,00 мл; б) 13,84 мл).
5.Определите молярную концентрацию эквивалента раствора хлорида железа (III), если в 0,3 л раствора содержится 32,44 г его. (Ответ: С[1/3(FeCl3)] = 2 моль/л).
6.Вычислите молярную концентрацию эквивалента 10%-го раствора CuSO4, плотность которого 1,107 г/мл. (Ответ: С(1/2 CuSO4) = 1,4 моль/л).
