
АНАЛИТИЧЕСКАЯ
ХИМИЯ
Сборник типовых задач и методические
указания
к их решению для самостоятельной работы
студентов второго курса фармацевтического
факультета
(задание 2)
Владивосток
2002
Настоящий
сборник призван помочь студенту в
самостоятельной работе при решении
типовых задач на использование закона
действия масс в гетерогенной системе.
Рекомендуется следующий порядок
выполнения задания 2.
1.
Повторение общих закономерностей
протекания реакций осаждения, закон
действия масс в гетерогенной системе.
2.
Изучение раздела 2 настоящего сборника:
методические указания и решение типовых
задач.
3. Решение задач
в соответствии с вариантом задания.
4.
Оформление решения задач и сдача задания
на проверку преподавателю.
Вариант задания
указывает преподаватель.
Варианты
задач Таблица
1
Номер
варианта
Номера
задач
1
01
41
81
121
161
201
2
02
42
82
122
162
202
3
03
43
83
123
163
203
4
04
44
84
124
164
204
5
05
45
85
125
165
205
6
06
46
86
126
166
206
7
07
47
87
127
167
207
8
08
48
88
128
168
208
9
09
49
89
129
169
209
10
10
50
90
130
170
210
11
11
51
91
131
171
211
12
12
52
92
132
172
212
13
13
53
93
133
173
213
14
14
54
94
134
174
214
15
15
55
95
135
175
215
16
16
56
96
136
176
216
17
17
57
97
137
177
217
18
18
58
98
138
178
218
19
19
59
99
139
179
219
20
20
60
100
140
180
220
21
21
61
101
141
181
221
22
22
62
102
142
182
222
23
23
63
103
143
183
223
24
24
64
104
144
184
224
25
25
65
105
145
185
225
26
26
66
106
146
186
226
27
27
67
107
147
187
227
28
28
68
108
148
188
228
29
29
69
109
149
189
229
30
30
70
110
150
190
230
31
31
71
111
151
191
231
32
32
72
112
152
192
232
33
33
73
113
153
193
233
34
34
74
114
154
194
234
35
35
75
115
155
195
235
36
36
76
116
156
196
236
37
37
77
117
157
197
237
38
38
78
118
158
198
238
39
39
79
119
159
199
239
40
40
80
120
160
200
240
Пример
1.
Вычислить произведение растворимости
иодида серебра
Решение.
Уравнение растворимости
осадка для
иодида серебра:
Уравнение
ионизации
для иодида
серебра:
Вычислим
растворимость иодида серебра в молях
на 1
[
При
диссоциации каждого моля
образуется 1 моль
1
моль
Произведение
растворимости иодида серебра
Подставив
значения
Пример
2.
Вычислить произведение растворимости
хромата серебра
Решение.
Уравнение растворимости осадка
Уравнение
ионизации соли:
Вычислим
растворимость хромата серебра в граммах
на 1
.
В
Молярная
масса
равна 331,73 граммам, тогда растворимость
хромата серебра в молях на 1
будет равна:
Из
уравнения ионизации
Произведение
растворимости хромата серебра имеет
вид
Пример
3.
Вычислить произведение растворимости
сульфата кальция
Решение.
Сульфат кальция,
Для
вычисления активности ионов необходимо
рассчитать ионную силу раствора и
определить коэффициенты активности.
Находим молярную концентрацию раствора,
если
Так
как каждая молекула посылает в раствор
по одному иону
Вычислим ионную
силу раствора по формуле
Коэффициент
активности может быть вычислен по
уравнению
Теперь вычислим
искомое произведение растворимости:
Экспериментально
измеренная величина
6,110
Пример
4. Вычислить
растворимость оксалата кальция
Решение.
Уравнение
растворимости оксалата кальция:
Уравнение
ионизации оксалата кальция:
Запишем
уравнение произведения растворимости
:
Из уравнения
ионизации следует:
Обозначим
растворимость
через
в
.
При ионизации
молей
в растворе образуется
молей
Подставляя
эти значения в выражение произведения
растворимости, получим
Чтобы
найти растворимость
в
,
необходимо растворимость в молях
умножить на молярную массу
;
Р
Пример
5. Вычислить
растворимость хлорида свинца
Решение.
Уравнение растворимости хлорида
свинца:
Уравнение ионзации
хлорида свинца:
Хлорид
свинца
Обозначим
растворимость
через
молей на
.
При диссоциации
молей
в растворе образуется
молей
и
Растворимость
с учетом коэффициентов активности
рассчитаем по формуле
Для
нахождения ионной силы раствора по
уравнению
необходимо
найти растворимость
в молях на
По
найденному значению концентрации
находим ионную силу раствора
По
таблице находим значение коэффициентов
активности ионов
По
полученным данным уточняем растворимость
осадка
с учетом коэффициентов активности:
Пример
6. Рассчитать
растворимость хлорида серебра
а)
в насыщенном растворе
;
б)
в
Решение.
а)
б)
Концентрация ионов
в растворе
увеличивается дополнительно за счет
ионизации
,
поэтому
а
так как
[Ag+
] + [Ag+]
[Cl-KCl]
– 1,56·10-10
= 0.
[Cl-]
= [KCl]
= 10-4
Моль/дм3
Подставляя
значения концентрации и решая квадратное
уравнение, получим
Если
не требуется особой точности в расчетах,
то растворимость
можно найти иначе. Поскольку
Совпадение
результатов, рассчитанных по первому
и второму способу, вполне удовлетворительно.
Пример
7. Образуется
ли осадок
Решение.
Найдем молярную концентрацию исходного
раствора
Условие
образования осадка определяется
неравенством
Так
как
и
- сильные электролиты, то
Найденная
величина ионного произведения больше
=
Пример
8.
Рассчитать:
а)
б)
,
при котором обеспечивается практическая
полнота осаждения
Решение.
a)
Осадок начинает осаждаться, когда
ионное произведение превысит
так
как
Из
определения полноты осаждения следует,
что
Решение.
Условие полного осаждения - снижение
исходной концентрации осаждаемого
иона до
Рассчитаем,
какова должна быть равновесная
концентрация карбонат иона, чтобы
осаждение было полным:
Известно,
что в растворе
отсюда
Пример
10. Какой
осадок выпадает первым, если к 0,1
Моль/дм3
раствора
Решение.
Концентрация ионов
Концентрации
ионов
,
необходимые для образования осадков
и
,
находим из выражений произведения
растворимости:
Поскольку
для образования осадка
необходима концентрация ионов серебра,
равная
Когда
же начнется выпадение осадка
?
Образование
осадка
начнется тогда, когда концентрация
ионов
одновременно будет удовлетворять
условиям, необходимым как для образования
,
так и
:
Это
произойдет тогда, когда концентрация
ионов иодида уменьшится настолько, что
концентрация
станет в
1-40.
Рассчитать произведение растворимости
малорастворимого электролита на
основании данных о растворимости (табл.
2).
Таблица 2
№
Название осадка
Формула
осадка
Растворимость
Примеча-
ние
01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40
Хлористое
серебро Бромистое
серебро Роданистое
серебро Иодистое
серебро Иодноватокислое
серебро Карбонат
бария Карбонат
стронция Фторид
свинца Оксалат
серебра Сернистокислое
серебро Сульфат
серебра Гидроксид
кобальта Оксалат
бария Хромат
бария Сульфат
бария Карбонат
кальция Оксалат
кальция Хромат
кальция Гидроксид
кадмия Оксалат
кадмия Карбонат
кадмия Карбонат
кобальта Оксалат
кобальта Фторид
кальция Фторид
стронция Карбонат
магния Магний
аммоний фосфат Гидроксид
магния Карбонат
марганца Оксалат
марганца Марганец
аммоний фосфат Гидроксид
марганца Сульфид
марганца Карбонат
никеля Цианид
никеля Бромид
свинца Хлорид
свинца Карбонат
свинца Иодид
свинца Сульфат
стронция
AgCl AgBr AgSCN AgJ AgJO3 BaCO3 SrCO3 PbF2 Ag2C2O4 Ag2SO3 Ag2SO4 Co(OH)2 BaC2O4 BaCrO4 BaSO4 CaCO3 CaC2O4 CaCrO4 Cd(OH)2 CdC2O4 CdCO3 CoCO3 CoC2O4 CaF2 SrF3 MgCO3 MgNH4PO4 Mg(OH)2 MnCO3 MnC2O4 MnNH4PO4 Mn(OH)2 MnS NiCO3 Ni(CN)2 PbBr2 PbCl2 PbCO3 PbJ2 SrSO4
0,00172
г/дм3 0,000118
г/дм3 0,000114
г/дм3 0,282·10-5
г/дм3 0,0525
г/дм3 0,0164
г/дм3 0,0059
г/дм3 0,4904
г/дм3 0,0425
г/дм3 1,553
·10-5
м/дм3 0,495
г в 100 см3
7,94·10-4
м/дм3 0,09
г/дм3 0,02775
г в100 см3 1,049·10-5
м/дм3 3,464
м/дм3 0,00538
г/дм3 0,8313
г в 200 см3 0,00571
г/дм3 0,00491
г в 200 см3 0,00276
г/дм3 3,74·10-7
м/дм3 7,379·10-3
в 200 см3 0,0158
г/дм3 0,12
г/дм3 4,58·10-3
м/дм3 0,008648
г/дм3 0,001429
г/дм3 2,439·10-3
в 500 см3 2,236·10-3
м/дм3 0,003
г в 200 см3 0,00187
г/дм3 1,376·10-4
в 100 см3 3,606·10-4
в 100 см3 1,957·10-8
м/дм3 0,0315
м/дм3 3,176·10-3
в 200 см3 7,307·10-5
г/дм3 0,000651
м/дм3 5,657·10-4
м/дм3
С
учетом f
С
учетом f
С
учетом f
С
учетом f
С
учетом f
С
учетом f
С
учетом f
С
учетом f
41-80. По величине произведения
растворимости вычислить растворимость
в Моль/дм3 и г/дм3 в насыщенном
растворе (табл. 3).
Таблица 3
№
Труднорастворимое
вещество
Формула
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
72
73
74
75
76
77
78
79 80
Иодид серебра
Иодноватокислое
серебро
Молибдат серебра
Оксалат серебра
Карбонат серебра
Хромат бария
Фторид бария
Сульфит бария
Фторид кальция
Гидрофосфат
кальция
Сульфат кальция
Гидроксид кобальта
Карбонат кобальта
Оксалат кобальта
Иодноватокислая
медь (II)
Гидроксид магния
Фторид магния
Карбонат никеля
Оксалат никеля
Хлорноватокислый
никель
Иодноватокислый
никель
Бромид свинца
Карбонат свинца
Хлорфторисый
свинец
Фторид свинца
Фосфат серебра
Сульфат серебра
Ванадат серебра
Вольфрамат
серебра
Арсенат бария
Бромат бария
Фосфат бария
Иодид висмута
Арсенат кальция
Фосфат кальция
Оксалат церия
Фосфат лития
Оксалат магния
Фторид магния Магний-аммоний
фосфат
AgJ
AgJO3
Ag2MoO4
Ag2C2O4
Ag2
CO3
BaCrO4
BaF2
BaSO4
CaF2
CaHPO4
CaSO4
Co(OH)2
CoCO3
CoC2O4
Cu
(JO3)2
Mg(OH)2
MgF2
NiCO3
NiC2O4
Ni
(ClO3)2
Ni(JO3)2
PbBr2
PbCO3 PbClF
PbF2
Ag3PO4
Ag2SO4
AgVO3
Ag2WO4
Ba3(AsO4)2
Ba(BrO3)2
Ba3(PO4)2
BiJ3
Ca3(AsO4)2
Ca3(PO4)2
Ce2(C2O4)3
Li3PO4
MgC2O4
MgF2 MgNH4PO4
8,3·10-17
3,0·10-6
2,8·10-12
3,5·10-11
8,2·10-12
1,2·10-10
1,1·10-6
8,0·10-7
4,0·10-11
2,7·10-7
9,1·10-6
6,3·10-15
1,4·10-13
6,3·10-8
7,4·10-8
1,8·10-11
6,5·10-9
1,3·10-7
4,0·10-10
1,3·10-15
1,4·10-8
9,1·10-6
7,49·10-14
2,8·10-9
2,7·10-8
1,3·10-20
1,6·10-5
5,0·10-7
5,5·10-12
7,8·10-51
5,5·10-6
6,03·10-39
8,1·10-19
6,8·10-19
2,0·10-29
2,5·10-29
3,2·10-9
8,6·10-5
6,5·10-9
2,5·10-13
81-120. По величине произведения
растворимости вычислить в Моль/дм3
и в г/дм3 в присутствии сильных
электролитов (табл. 4).
Таблица 4
№ задачи
Формула
Сильный
электролит
Концентрация
сильного электролита
81
82
83
84
85
86
87
88
89
90
91
92
93
94
95
96
97
98
99
100
101
102
103
104
104
106
107
108
109
110
111
112
113
114
115
116
117
118
119 120
BaCO3
Ag2C2O4
BaBrO3
CaF2
Co(OH)2
(Cu)2SO4
PbJ2
SrF2
PbSO4
TbJO3
ZnCO3
Zn(OH)2
PbF2
CaCO3
SrSO4
BaF2
Fe(OH)2
Ag2CO3
MgNH4PO4
BaC2O4
SrCrO4
CaCrO4
MnC2O4 MnS
NiCO3 AgJ
AgJO3
Ag2MoO4
Ag2C2O4
Ag2CO3
PbF2
PbCl2
PbCO3
PbBr2
Ni(JO3)2
MgF2
Mg(OH)2
Co(OH)2
CoCO3
Mn(OH)2
5,1·10-9
1,1·10-12
3,3·10-5
3,4·10-11
1,6·10-18
2,6·10-49
7,5·10-9
3,4·10-9
2,2·10-8
3,4·10-6
2,7·10-9
1,0·10-17
3,2·10-8
1,7·10-8
3,6·10-7
1,7·10-6
3,3·10-16
5,0·10-12
2,5·10-13
1,1·10-7
3,6·10-5
7,1·10-4
5,0·10-6
2,5·10-10
1,3·10-7
8,3·10-17
3,0·10-8
2,8·10-12
3,5·10-11
8,2·10-12
2,7·10-8
2,8·10-9
7,49·10-14
9,0·10-6
1,4·10-8
6,5·10-9
1,8·10-11
6,3·10-15
1,4·10-13
1,9·10-13
Na2CO3 (NH4)2C2O4 Ba(NO3)2 NaF NaOH (NH4)2SO4 KJ NH4F H2SO4 KJO3 K2CO3 ZnSO4 NaF Ca(NO3)2 Na2SO4 BaCl2 NaOH K2CO3 NH4Cl (NH4)2C2O4 (NH4)2CrO4 (NH4)2CrO4 Na2C2O4 MnCl2 (NH4)2CO3 KJ KJO3 Na2MoO4 Na2C2O4 Na2CO3 NaF NaCl Na2CO3 KBr KJO3 NaF NaOH NaOH Na2CO3 NaOH
1 %
0,01 N
0,02 M 2
%
0,02 N
0,2 N
0,5 N
0,01 N
0,02 M
0,05 N
0,01 M 0,5
%
0,01 M
0,1 M 0,01
0,2 M 0,2
%
0,02 M
0,2 M 0,01
M 1
%
0,1 N
0,02 N
0,1 M
0,01 N 1
%
0,01 N
0,002 N
0,02 N
0,01 M
0,001 M 0,3
%
0,02 N
0,1 M 0,5
%
0,1 M
0,001
M
0,001 M 0,3
% 0,001
N
121-160. Вычислить pH,
при котором начинается осаждение трудно
растворимого электролита, если
концентрация осаждаемого иона металла
равна 10-12 Моль/дм3
(табл. 5).
Таблица 5
№ задачи
Формула электролита
Осадитель
Формула
Концентрация
121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160
Fe(OH)3
Fe(OH)2
Zn(OH)2
Co(OH)2
Cd(OH)2
Tl(OH)3
Cr(OH)3
Cu(OH)2
Mg(OH)2
Mn(OH)2
Ag2CO3
Ag2C2O4
Ag2CrO4
BaCO3
CaCO3
SrCO3
MnCO3
PbS
MnS
NiS
PbCrO4
ZnS
CuC2O4
CaC2O4
CaSO3
ZnS
NiS
MnCO3
SrCO3
Ag2Cr2O7
Ag2SO3
CuCO3
CuCrO4
BaSO3
MnCO3
MnS
NiC2O4
FeS
PbC2O4
ZnC2O4
3,8·10-38
3,3·10-66
7,1·10-18
2,0·10-15
2,0·10-14
10-32
6,7·10-31
2,2·10-20
1,8·10-11
2,0·10-13
8,2·10-12
3,5·10-12
1,1·10-12
5,1·10-9
4,8·10-9
1,6·10-9
1,8·10-11
2,5·10-27
2,5·10-13
3,2·10-19
1,8·10-14
2,5·10-22
3,0·10-8
2,3·10-9
1,3·10-8
2,5·10-22
3,2·10-19
1,8·10-11
1,6·10-9
1,0·10-10
1,5·10-14
2,5·10-10
3,6·10-10
8,0·10-7
1,8·10-11
2,5·10-10
4,0·10-10
5,0·10-18
4,8·10-10
1,5·10-9
NaOH
NaOH
NaOH
KOH
KOH
KOH
KOH
NaOH
NaOH
KOH
(NH4)2CO3
(NH4)2C2O4
(NH4)2CrO4
(NH4)2CO3
(NH4)2CO3
(NH4)2CO3
(NH4)2CO3
H2S
(NH4)2S
(NH4)2S
(NH4)2CrO4
H2S
(NH4)2C2
O4
(NH4)2C2
O4
(NH4)2SO3
(NH4)2S
(NH4)2S
(NH4)2CO3
(NH4)2CO3
(NH4)2Cr2
O7
(NH4)2SO3
(NH4)2CO3
(NH4)2Cr
O4
(NH4)2SO3
(NH4)2C
O3
H2S
H2C2O4
H2S
H2C2O4
H2C2O4
0,1 N
0,02 N
0,05 N
0,05 M
0,02 N
0,01 M
0,1
M
0,2 N
0,1 M
0,1 M
0,1M
0,1 N
0,1 M
0,1 M
0,2 N
0,1 M
0,05 M
0,1 M
0,1 M
0,2 N
0,2 N
0,1 N
0,2 N
0,1 M
0,1 M
0,02 N
0,002 N
0,001 M
0,02 N
0,1 M
0,1 M
0,2 N
0,1 M
0,05 M
0,01 M
0,1 M
0,02 N
0,1 M
0,1 M
0,2 N
161-200. Вычислить pH,
при котором достигается практическая
полнота осаждения ионов металла (табл.
6).
Таблица 6
№ задачи
Формула
электролита
Осадитель
Формула
Концентрация
1
2
3
4
5
161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200
Cd(OH)2
BaCrO4
SrCrO4
PbCrO4
Ag2CrO4
CaC2O4
BaC2O4
SrC2O4
Ag2
C2O4
CuC2O4
CaCO3
BaCO3
SrCO3
MnCO3
Ag2CO3
Mn S
Zn S
Ni S
Fe S
Co(OH)2
Fe(OH)2
Mn
(OH)2
Mg(OH)2
Zn(OH)2
ZnS
MnCO3
ZnC2O4
MnS
Ag2CrO4
Ag2
C2O4
Ag2CO3
Mn(OH)2
Mg(OH)2
PbCrO4
CuC2O4
CaSO3
CdCО3
Ag2
Cr2O7
CaCO3
CaC2O4
5,9·10-15
1,2·10-10
2,5·10-9
1,8·10-14
1,1·10-12
2,3·10-9
1,1·10-7
5,6·10-8
3,5·10-12
3,0·10-8
4,8·10-9
5,1·10-9
1,6·10-9
1,8·10-11
8,2·10-12
2,5·10-10
2,5·10-22
3,2·10-19
5,0·10-18
2,0·10-15
3,3·10-16
1,9·10-13
6,0·10-10
7,1·10-18
2,5·10-22
1,8·10-11
1,5·10-9
2,5·10-10
1,1·10-12
3,5·10-12
8,2·10-12
2,0·10-13
1,8·10-11
1,8·10-14
3,0·10-8
1,3·10-8
5,2·10-12
1,0·10-10
4,8·10-9
2,3·10-9
KOH
(NH4)2CrO4
(NH4)2CrO4
(NH4)2CrO4
(NH4)2CrO4
(NH4)2C2
O4
(NH4)2C2
O4
(NH4)2C2
O4
(NH4)2C2
O4
(NH4)2C2
O4
(NH4)2C
O3
(NH4)2C
O3
(NH4)2C
O3
(NH4)2C
O3
(NH4)2C
O3
(NH4)2S
H2S
H2S
(NH4)2S
KOH
KOH
NaOH
NaOH
NaOH
(NH4)2S
(NH4)2CO3
H2C2O4
H2S
(NH4)2CrO4
H2C2O4
(NH4)2CO3
NaOH
KOH
(NH4)2CrO4
H2C2O4
Na2SO3
(NH4)2CO3
(NH4)2Cr2O7
(NH4)2C
O3
H2C2O4
0,1 M
0,1 M
0,2 N
0,05 M
0,05 M
0,1 M
0,02
N
0,05 M
0,01 M
0,2 N
0,1 M
0,2 N
0,05 M
0,01 M
0,02 N
0,1 M
0,1 M
0,1 M
0,02 N
0,1 N
0,02 N
0,1 M
0,1 N
0,5 N
0,02 N
0,001 M
0,2 N
0,1 M
0,01 N
0,002 N
0,01 M
0,05 M
0,5 %
0,002 N
0,01 M
0,02 N
0,02 N
0,1 M
0,01 M
0,01 M
Вычислить,
выпадает ли осадок трудно растворимого
электролита при смешивании равных
объемов указанных электролитов
(табл.7).
Таблица 7
№
зада- чи
Электролит
Концент- рация
Электролит
Концент- рация
Осадок
1
2
3
4
5
6
7
201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 226 227 228 229 230 231 232 233 234 235 236 237 238 239 240
AgNO3
AgNO3
AgNO3
AgNO3
AgNO3
AgNO3
AgNO3
AgNO3
BaCl2
BaCl2
BaCl2
BaCl2
BaCl2
CaCl2
CaCl2
CaCl2
CaCl2
Bi(NO3)3
Cd(NO3)2
Cd(NO3)2
Ce(NO3)3
Ce(NO3)3
CrCl3
CoCl2
CuSO4
CuSO4
FeCl2
MgCl2
MgCl2
MnCl2
MnCl2
NiCl2
NiCl2
NiCl2
Pb(NO3)2
Pb(NO3)2
SrCl2
SrCl2
SrCl2
ZnCl2
0,1 N
0,2 N
0,1
N
0,02 M
0,05 M
0,2
N
0,1 M
0,5 M
0,1
N
0,2
N
0,1 M
0,01 M
0,05 M
0,05 M
0,02 M
0,01 M
0,2 M
0,03 M
0,02 M
0,02 M
0,02
N
0,03
N
0,01 M
0,1 M
0,02
N
0,01 M
0,02
N
0,2 N
0,1 N
0,1 M
0,01
N
0,02
N
0,1 M
0,05 M
0,01 M
0,2
N
0,2
N
0,1 M
0,2 M 0,1
N
KBrO3
KCN
(NH4)
2CO3
(NH4)2C2
O4 HCl
(NH4)2CrO4
K2Cr2O7
Na2SO3
(NH4)2CO3
(NH4)2C2
O4
(NH4)2CrO4
NaF
H2SO4
(NH4)2CO3
(NH4)2C2
O4
(NH4)2CrO4
NaF KJ
KCN
(NH4)2CO3
KJO3
KOH
Na3PO4
KJO3
KBr
Na2CO3
(NH4)2C2
O4
(NH4)2CO3
(NH4)2C2
O4
(NH4)2CO3
Na2C2O4
K2CO3
(NH4)2C2
O4
KJO3
NaJ
Na2S2O3
K2CrO4
NaF
KJO3 KCN
0,1 N
0,01
M
0,1 M
0,2 M
0,1 M
0,02 M
0,1 M
0,2 M
0,1 M
0,05 N
0,02 M
0,1 M
0,2 M
0,05 M
0,02 M
0,02 N
0,1 M
0,01 N
0,01 M
0,02 M
0,01 M
0,01 N
0,03 N
0,1 N
0,01 M
0,1 M
0,2 N
0,1 M
0,1 M
0,02 N
0,1 M
0,2 N
0,1 M
0,05 M
0,1 M
0,5 N
0,2
N
0,1 M
0,05 N 0,001
N
AgBrO3 AgCN
Ag2CO3
Ag2C2O4 AgCl
Ag2CrO4
Ag2Cr2O7
Ag2SO3
BaCO3
BaC2O4
BaCrO4
BaF2
BaSO4
CaCO3
CaC2O4
CaCrO4
CaF2
BiJ3
Cd(CN)2
CdCO3
Ce(JO3)3
Ce(OH)3
CePO4
Co(JO3)2
CuBr2
CuCO3
FeC2O4
MgCO3
Mg2C2O4
MnCO3
MnC2O4
NiCO3
NiC2O4
Ni(JO3)2
PbJ2
PbS2O3
SrCrO4
SrF2
Sr(JO3)2 Zn(CN)2
5,5·10-5
1,4·10-16
8,2·10-12
3,5·10-11
1,78·10-10
1,1·10-12
1,0·10-10
1,5·10-5
5,1·10-9
1,1·10-7
1,2·10-10
1,1·10-6
1,1·10-10
4,8·10-9
2,3·10-9
7,1·10-4
4,0·10-11
8,1·10-19
1,0·10-8
5,8·10-12
3,2·10-10
1,5·10-20
1,0·10-17
1,0·10-4
5,25·10-9
2,5·10-10
2,0·10-7
2,1·10-5
8,6·10-5
1,8·10-11
5,0·10-6
1,3·10-7
4,0·10-10
1,4·10-8
1,1·10-9
4,0·10-7
3,6·10-5
2,5·10-9
3,3·10-7
2,6·10-13
Рекомендуемая
литература
1.
Алексеев В.И. Курс качественного
химического полумикроанализа. М.: Б
1973. С. 148-184.
2. Воскресенский А.Г., Солодкин И.С.,
Семиколенов Г.Ф. Сборник задач и
упражнений по аналитической химии. М.:
, 1985. С. 44-53.
3. Ярославцев А.А. Сборник задач и
упражнений по аналитической химии. М.:
, 1966. С. 70-77.
Введение…………………………………………………...2
Варианты задач ……………………………………….3
Методические указания к решению типовых
зада.4-9
Варианты задач для самостоятельной
работы …10-15
Рекомендуемая литература …………………...……
16Владивостокский государственный медицинский университет
Введение
11. Методические указания к решению типовых задач
![]() ,
если растворимость этой соли при
температуре
,
если растворимость этой соли при
температуре
![]() равна
равна
![]()
![]()
![]()
![]() .
Так как молярная масса
составляет 234,8 г, то концентрация
раствора:
.
Так как молярная масса
составляет 234,8 г, то концентрация
раствора:![]() ]
=
]
=
![]() =
=
![]() .
.![]() и
и
![]() .
Следовательно, их концентрации равны:
.
Следовательно, их концентрации равны:![]()
![]() можно
выразить произведением концентраций,
так как эта соль относится к трудно
растворимым
можно
выразить произведением концентраций,
так как эта соль относится к трудно
растворимым
![]()
![]()
![]() и
и
![]() в
уравнение произведения растворимости,
получим:
в
уравнение произведения растворимости,
получим:
![]() =
=![]()
![]() ,
если в
,
если в
![]() насыщенного его раствора содержится
0,002156 г.
насыщенного его раствора содержится
0,002156 г.![]() :
:![]()
![]()
![]() насыщенного раствора содержит
0,002156 граммов
соли,
в 1000
насыщенного раствора содержит
0,002156 граммов
соли,
в 1000
![]() насыщенного
раствора находится
насыщенного
раствора находится
![]() граммов
соли.
граммов
соли.![]() =
=
![]() = 0,02156
= 0,02156
![]() .
.![]() =
=
![]() =
=
![]()
![]() следует, что
следует, что
![]()
![]() .
.![]() .
Подставляя в это выражение значения
.
Подставляя в это выражение значения
![]() и
и
![]() ,
получим:
,
получим:![]()
![]() ,
если при
его растворимость равна
,
если при
его растворимость равна
![]()
![]() ,
сравнительно хорошо растворяется в
воде, поэтому произведение растворимости
этой соли определяется произведением
активности ионов
,
сравнительно хорошо растворяется в
воде, поэтому произведение растворимости
этой соли определяется произведением
активности ионов
![]() и
и
![]() :
:
![]() .
.![]()
![]()
![]() и
и
![]() ,
их концентрация
,
их концентрация
![]()
![]() =
=![]()
![]()
![]() или определён по таблице коэффициентов
активности (для двухзамещенных ионов
или определён по таблице коэффициентов
активности (для двухзамещенных ионов
![]() ).
).![]()
![]()
![]() .Такое
совпадение расчетной и экспериментальной
величин можно считать удовлетворительным.
.Такое
совпадение расчетной и экспериментальной
величин можно считать удовлетворительным.![]() в
в
![]() и в
и в
![]() ,
если произведение растворимости его
равно
,
если произведение растворимости его
равно
![]() .
.![]()
![]()
![]() .
.![]()
![]() и
молей
и
молей
![]() ,
следовательно,
,
следовательно,
![]() ,
,
![]() .
.![]() .
.![]() =
=
![]()
![]() ,
где
,
где
![]() -
молярная масса оксалата кальция.
-
молярная масса оксалата кальция.![]() в молях на
в молях на
![]() с учетом коэффициента активности, если
произведение растворимости соли равна
с учетом коэффициента активности, если
произведение растворимости соли равна
![]() .
.![]()
![]()
![]() сравнительно хорошо растворяется в
воде, поэтому произведение растворимости
этой соли определяется произведением
активности ионов
сравнительно хорошо растворяется в
воде, поэтому произведение растворимости
этой соли определяется произведением
активности ионов
![]() и
и
![]() :
:![]()
![]() молей
,
следовательно,
молей
,
следовательно,
![]() ;
;
![]() .
Подставим эти значения в выражение
произведения, получим
.
Подставим эти значения в выражение
произведения, получим![]()
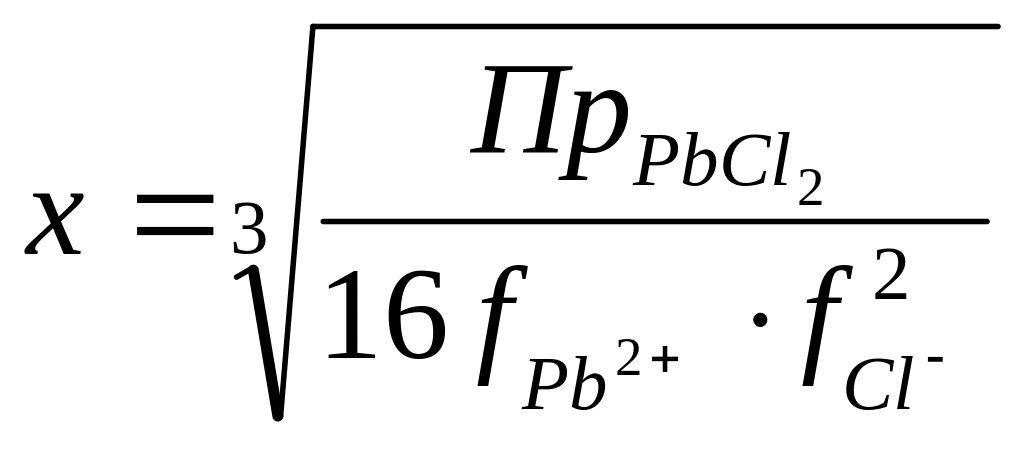 .
.![]()
![]() без учета коэффициентов активности:
без учета коэффициентов активности:![]()
![]()
![]()
![]() и
и
![]() при ионной силе раствора 0,5:
при ионной силе раствора 0,5:
![]() =0,45,
=0,45,
![]() =0,81.
=0,81.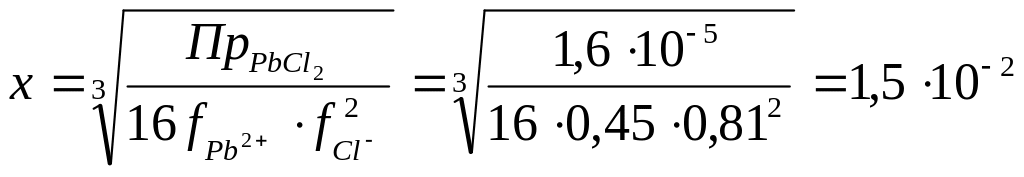 .
.![]() :
:
![]() Моль/дм3
растворе
Моль/дм3
растворе
![]() (
(![]() ).
).![]() ;
так как в насыщенном растворе
;
так как в насыщенном растворе
![]() ,
то
,
то
![]() .
.![]() ,
,![]() в
,
то
в
,
то
![]()
![]() .
.![]()
![]() ,
то
,
то
![]() ,
тогда
,
тогда
![]() следовательно, растворимость можно
найти из следующего уравнения:
следовательно, растворимость можно
найти из следующего уравнения:![]() .
.![]() ,
если к раствору, содержащему 2,05 г
,
если к раствору, содержащему 2,05 г
![]() в
,
прилить равный объем 0,01 М раствора
в
,
прилить равный объем 0,01 М раствора
![]() ?
?
![]() .
.![]() .
Молярная масса
равна 205,24.
.
Молярная масса
равна 205,24.![]()
![]()
![]() ,
т.е. ионное произведение должно быть
больше произведения растворимости.
Найдем концентрации ионов осадка,
учитывая, что при сливании равных
объемов осаждаемого вещества и осадителя
произойдет разбавление в два раза.
,
т.е. ионное произведение должно быть
больше произведения растворимости.
Найдем концентрации ионов осадка,
учитывая, что при сливании равных
объемов осаждаемого вещества и осадителя
произойдет разбавление в два раза.![]() =0,01Моль/дм3;
с учетом разбавления
=0,01Моль/дм3;
с учетом разбавления
![]() ,
,
![]() ;
с учетом разбавления
;
с учетом разбавления
![]() .
Подставив найденные значения
концентраций, определяем:
.
Подставив найденные значения
концентраций, определяем:
![]() .
.![]() ,
т.е. 2,5·10-5
>1,1·10-10,
следовательно, осадок
образуется.
,
т.е. 2,5·10-5
>1,1·10-10,
следовательно, осадок
образуется.![]() начала осаждения гидроксида магния;
начала осаждения гидроксида магния;![]() ,
если осаждение ведут из 0,010Моль/дм3
раствора
,
если осаждение ведут из 0,010Моль/дм3
раствора
![]()
![]() .
.![]() .
Для простоты расчетов примем
.
Для простоты расчетов примем
![]() и
и
![]() равными единице. В этом случае
равными единице. В этом случае
![]() ,
отсюда
,
отсюда
![]()
![]() б)
Практической полнотой осаждения принято
считать в аналитической химии такую
концентрацию ионов, оставшихся в
растворе после осаждения осадка, которая
равна
б)
Практической полнотой осаждения принято
считать в аналитической химии такую
концентрацию ионов, оставшихся в
растворе после осаждения осадка, которая
равна
![]()
![]() тогда будем иметь
тогда будем иметь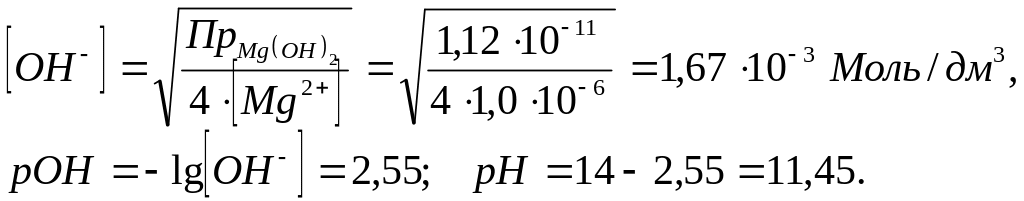 Пример
9. Рассчитайте
,
при котором произойдет количественное
осаждение карбоната бария 0,5 Моль/дм3
раствором карбоната аммония
Пример
9. Рассчитайте
,
при котором произойдет количественное
осаждение карбоната бария 0,5 Моль/дм3
раствором карбоната аммония
![]()
![]() ,
следовательно,
,
следовательно,
![]() в растворе после осаждения.
в растворе после осаждения.![]()
![]() ,
равновесная концентрация карбонат-ионов
связана с общей концентрацией карбоната
аммония и ионов водорода следующим
уравнением:
,
равновесная концентрация карбонат-ионов
связана с общей концентрацией карбоната
аммония и ионов водорода следующим
уравнением:
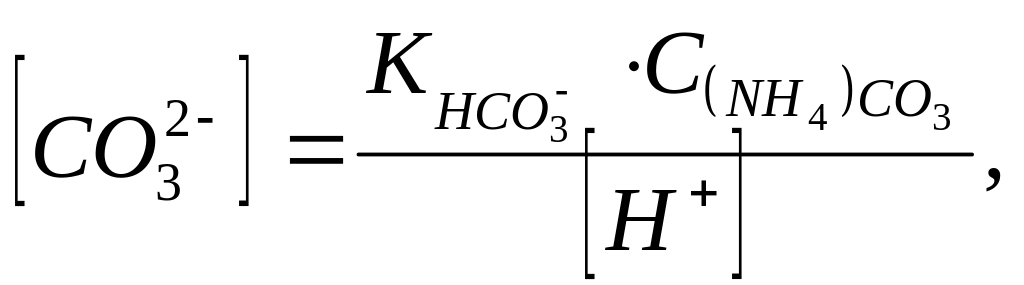
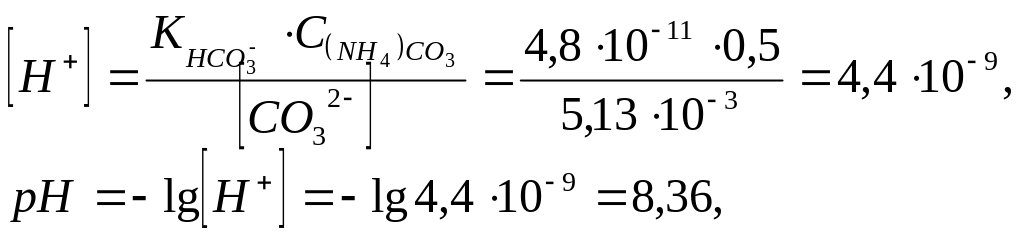
![]() и
и
![]() по каплям прибавлять раствор нитрата
серебра?
по каплям прибавлять раствор нитрата
серебра?
![]()
![]() и
:
и
:![]()
![]()

![]() ,
то его произведение растворимости
будет достигаться раньше чем у
.
,
то его произведение растворимости
будет достигаться раньше чем у
.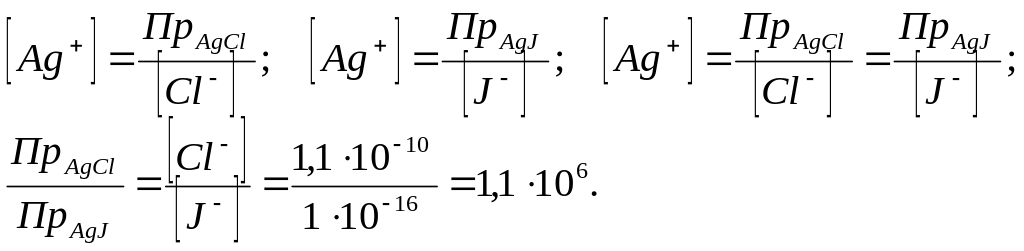
![]() раз больше нее.
раз больше нее.3. Варианты задач для самостоятельной работы
![]()
Оглавление
2
31
3
30
4
29
5
28
6
27
7
26
8
25
9
24
10
23
11
22
12
21
13
20
14
19
15
18
16
17
