
- •Дніпропетровськ 2005 Укладачі: о.М. Гулівець, д.М. Волнянський, с.Ю. Копилова, р.П. Ганич, л.М. Клімкович
- •Лабораторна робота №10 визначення розподілу максвелла
- •Теоретичні відомості
- •Порядок виконання роботи
- •Контрольні питання
- •Лабораторна робота №11 визначення коефіцієнта внутрішнього тертя рідини за методом стокса
- •Теоретичні відомості
- •Порядок виконання роботи
- •Порядок виконання роботи
- •Опис приладу
- •Порядок виконання роботи
Порядок виконання роботи
1. За допомогою вимірювального мікроскопу визначити діаметр кульки.
2. Опустити кульку в рідину поблизу осі циліндру.
3. По досягненні кулькою верхньої мітки (а) на циліндрі, ввімкнути секундомір, по досягненні нижньої (б) – зупинити секундомір.
4. Виміряти відстань між мітками на циліндрі. Дослід провести для п’яти кульок.
5. Розрахувати коефіцієнт в’язкості рідини для кожного досліду за формулою (4).
Таблиця 1
№ п/п |
, м |
, м |
, с |
, Па с |
|
|
|
|
|
1 2 3 4 5 |
|
|
|
|
|
|
|
|
|
Сер. |
|
|
|
|
|
|
|
|
|
6.
Знайти довірчий інтервал:
![]() ,
де
,
де
![]() -
коефіцієнт Стьюдента при n
=
5 і p=0.95.
-
коефіцієнт Стьюдента при n
=
5 і p=0.95.
 ; де
; де
![]() .
.
7.
Записати результат у вигляді:
![]() при р=0,95;
при р=0,95;
![]()
Контрольні питання.
1. Назвіть явища переносу.
2. Які сили діють на кульку, що падає в рідині?
3. Чому, починаючи з деякого моменту часу, кулька рухається рівномірно?
4. Як змінюється швидкість руху кульки із збільшенням її діаметра?
5. Що називається градієнтом швидкості та як він спрямований?
6. Що таке в’язкість?
У яких одиницях вимірюється коефіцієнт в’язкості?
Лабораторна робота №12
ВИЗНАЧЕННЯ СПІВВІДНОШЕННЯ ТЕПЛОЄМНОСТЕЙ ГАЗУ
ПРИ ПОСТІЙНОМУ ТИСКУ ТА ПОСТІЙНОМУ ОБ’ЄМІ
ЗА МЕТОДОМ КЛЕМАНА-ДЕЗОРМА
Теоретичні відомості
Під теплоємністю тіла розуміють кількість теплоти, необхідної для нагрівання цього тіла на 1К. Теплоємність одиниці маси речовини називають питомою теплоємністю. Вводять ще молярну теплоємність – це теплоємність одного моля газу. Молярні теплоємності газів з однаковим числом атомів у молекулі рівні.
Теплоємність газу залежить від умов нагрівання. Розрізняють теплоємність газу при постійному об’ємі Сv та теплоємність при постійному тиску Cp.
Можна показати, що Cp > Cv.
Справді, якщо нагрівати один моль газу на 1К при постійному об’ємі, то надане йому тепло піде тільки на збільшення внутрішньої енергії газу. Якщо ж нагріти газ на 1 К при постійному тиску (тобто надати йому можливість розширюватися), то, крім зазначеної кількості тепла, йому потрібно надати ще деяку кількість тепла, необхідного для виконання роботи розширення:
![]() .
.
Таким
чином,
![]() .
.
Це
рівняння називається рівнянням Майера.
Для всіх газів, до складу молекул яких
входить одна й та сама кількість атомів,
величина відношення
![]() однакова.
однакова.
Як
показує теоретичний розрахунок,
![]() ,
де
,
де
![]() -
кількість ступенів вільності молекул
газу.
-
кількість ступенів вільності молекул
газу.
Відношення теплоємкостей входить у вигляді показника ступеня в рівнянні адіабатичного процесу.
Це рівняння називається рівнянням Пуассона і має вигляд
![]() . (1)
. (1)
Адіабатичним процесом називається процес, що проходить без теплообміну з зовнішнім середовищем. Швидке стискання чи розширення газу можна вважати адіабатичним процесом, тому що за дуже малий проміжок часу теплообмін з зовнішнім середовищем практично не встигає відбутися.
Величина може бути виміряна експериментально за допомогою методу Клемана-Дезорма.
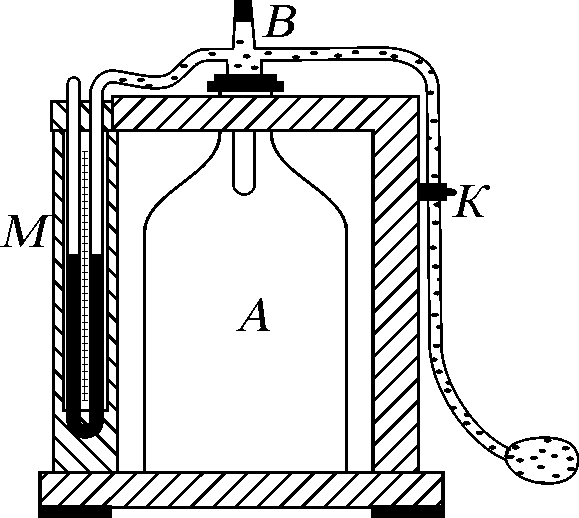
Рис. 1
Прилад для вимірів складається із скляного балона, закритого пробкою, у яку вставлена трубка з отворами, через які балон сполучається з відкритим манометром М і насосом К (рис.1).
При
закритому отворі В
накачаємо в балон А
деяку кількість повітря. Тиск повітря
в балоні зросте і стане рівним
![]() ,
де
,
де
![]() - надлишок тиску повітря в балоні над
атмосферним тиском. При накачуванні
повітря (що стискається під поршнем
насоса) нагрівається, тому необхідно
очікувати 2-3 хвилини, поки завдяки
теплообміну температура в балоні стане
дорівнювати кімнатній. Після цього
вимірюють за манометром надлишковий
тиск повітря
.
- надлишок тиску повітря в балоні над
атмосферним тиском. При накачуванні
повітря (що стискається під поршнем
насоса) нагрівається, тому необхідно
очікувати 2-3 хвилини, поки завдяки
теплообміну температура в балоні стане
дорівнювати кімнатній. Після цього
вимірюють за манометром надлишковий
тиск повітря
.
Позначимо
об’єм посудини
![]() та приймемо цей стан за початковий. Він
буде характеризуватися об’ємом
та приймемо цей стан за початковий. Він
буде характеризуватися об’ємом
![]() ,
тиском
та температурою
,
тиском
та температурою
![]() .
Потім швидко відчинимо отвір В і закриємо
його в той час, коли рівні рідини в
манометрі зрівняються при опусканні
правого стовпа рідини.
.
Потім швидко відчинимо отвір В і закриємо
його в той час, коли рівні рідини в
манометрі зрівняються при опусканні
правого стовпа рідини.
Після
цього тиск повітря стане рівним
атмосферному
![]() ,
об’єм збільшиться до
,
об’єм збільшиться до
![]() ,
а температура понизиться до
,
а температура понизиться до
![]() (другий стан). Цей процес є практично
адіабатичним (швидке розширення).
(другий стан). Цей процес є практично
адіабатичним (швидке розширення).
Через
якийсь час повітря знову прийме
температуру навколишнього середовища
,
а тиск, унаслідок підвищення температури,
зросте до
![]() ,
де
,
де
![]() -
різниця рівнів рідини в манометрі. Слід
зазначити, що маса повітря, що залишилася,
знаходиться тепер під тиском
.
Частина повітря, випущена в атмосферу
при адіабатичному розширенні, знаходиться
під атмосферним тиском
.
Але тому що ця частина невелика, то ми
зневажаємо цією обставиною і вважаємо
об’єм газу в третьому стані рівним
.
Весь хід зміни стану повітря можна
показати у вигляді табл.1.
-
різниця рівнів рідини в манометрі. Слід
зазначити, що маса повітря, що залишилася,
знаходиться тепер під тиском
.
Частина повітря, випущена в атмосферу
при адіабатичному розширенні, знаходиться
під атмосферним тиском
.
Але тому що ця частина невелика, то ми
зневажаємо цією обставиною і вважаємо
об’єм газу в третьому стані рівним
.
Весь хід зміни стану повітря можна
показати у вигляді табл.1.
Таблиця 1
Стан газу |
Об’єм |
Тиск |
Температура, 0С |
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
Перехід з першого стану в другий відбувається адіабатично, тому цей процес можна описати рівнянням Пуассона (1):
![]() ,
відкіля
,
відкіля  .
(2)
.
(2)
У
першому та третьому станах температура
газу однакова, тому до цих станів можна
застосувати закон Бойля-Маріотта
![]() ,
відкіля
,
відкіля
![]() .
.
Зведемо (3) у ступінь
 . (4)
. (4)
Порівнюючи (2) і (4), одержимо
 .
.
Про логарифмуємо цей вираз:
![]() ,
,![]()
Відкіля
![]() .
(5)
.
(5)
Спростимо
отриманий вираз, використовуючи ту
обставину, що
![]() ,
якщо
,
якщо
![]() .
Для цього напишемо (5) у вигляді
.
Для цього напишемо (5) у вигляді
 ,
,
тому
що
![]() значно менше одиниці (перевищення тиску
в балоні над атмосферним значно менше
атмосферного тиску), то
значно менше одиниці (перевищення тиску
в балоні над атмосферним значно менше
атмосферного тиску), то
 чи
чи
![]() . (6)
. (6)
Отримана
формула використовується для визначення
,
тобто задача визначення
![]() зводиться
до виміру рівнів води в манометрі при
різних станах повітря, що знаходиться
у балоні.
зводиться
до виміру рівнів води в манометрі при
різних станах повітря, що знаходиться
у балоні.
