
- •Тема : Способы выражения состава растворов. Приготовление растворов. Теоретический материал к занятию:
- •Формулы перехода от одних способов выражения состава раствора к другим
- •Тема: Способы выражения состава растворов. Приготовление растворов Решение задач
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Тема: Количественный анализ. Теоретический материал к занятию:
- •Домашнее задание:
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Лабораторная работа. Определение массы гидроксида натрия в растворе.
- •Тема: Принципы качественного анализа. Теоретический материал к занятию:
- •Лабораторная работа. Качественные и групповые реакции ионов.
- •Модуль №02.
- •Примеры решения типовых задач Пример 1
- •Пример 2
- •Пример 3.
- •Пример 4.
- •Пример 5.
- •Пример 6.
- •Пример 7.
- •Пример 8.
- •Пример 9.
- •Пример 10.
- •Для реакции
- •Пример 11.
- •Лабораторная работа. Определение стандартной энтальпии реакции нейтрализации.
- •Тема: Химическая кинетика. Теоретический материал к занятию:
- •Истинная скорость (в любой момент времени) определяется первой производной концентрации по времени:
- •Примеры решения типовых задач Пример 1
- •Определите порядок реакции
- •Пример 2
- •Пример 3
- •Пример 4
- •Пример 5
- •Для ответа на вопрос а) воспользуемся модифицированым уравнением:
- •Пример 6
- •Пример 7
- •Пример 8
- •Пример 9
- •Пример 10
- •Пример 11
- •Пример 12
- •Лабораторная работа. Определение кинетических характеристик реакции окисления йодид йонов пероксидом водорода. (Оценка практических навыков.)
- •Приготовление реакционной смеси.
- •Проведение измерений при комнатной температуре.
- •Проведение измерений при повышенной температуре.
- •Проведение измерений в присутствии катализатора.
Ф![]() .И.О.____________________________
Группа _______________ Факультет
______________________
.И.О.____________________________
Группа _______________ Факультет
______________________
Министерство здравоохранения и социального развития Российской Федерации
Государственное бюджетное образовательное учреждение высшего профессионального образования
ПЕРВЫЙ МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ имени И.М. СЕЧЕНОВА

ОБУЧАЮЩАЯ ЛАБОРАТОРНАЯ ТЕТРАДЬ
ПО КУРСУ ОБЩЕЙ ХИМИИ

СТУДЕНТА_____________________ ГРУППЫ
__________________________ФАКУЛЬТЕТА
__________________________ОТДЕЛЕНИЯ
ФАМИЛИЯ _____________________________
ИМЯ ___________________________________
ОТЧЕСТВО _____________________________
ПРЕПОДАВАТЕЛЬ ______________________
20___ - 20____ учебный год
Москва

ОСНОВНЫЕ ПРАВИЛА РАБОТЫ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
И ТЕХНИКА ВЫПОЛНЕНИЯ ХИМИЧЕСКОГО ЭКСПЕРИМЕНТА
Правила поведения в химической лаборатории и технику безопасности:
к эксперименту приступают только после ознакомления со всеми его этапами;
на лабораторном столе должны находиться только необходимые для эксперимента приборы, оборудование лабораторный журнал;
в лаборатории работают только в халате;
нельзя брать руками вещества и пробовать их на вкус;
опыты с ядовитыми и летучими веществами, концентрированными растворами кислот и щелочей проводят под тягой;
при приливании реактивов нельзя наклоняться над отверстием сосуда во избежание попадания брызг на лицо и одежду;
нельзя работать с легковоспламеняющимися жидкостями вблизи включенных электрических и нагревательных приборов;
нельзя выливать в раковину остатки кислот, щелочей и огнеопасных веществ их следует сливать в специально предназначенные для этого склянки;
для засасывания кислот и щелочей в пипетку пользуются резиновыми грушами;
разбавляя концентрированные кислоты, осторожно вливают кислоту в воду, а не наоборот.
При несоблюдении правил техники безопасности в лаборатории, бывают несчастные случаи, требующие первой неотложной помощи, для ее оказания в лаборатории должна быть аптечка. Основные правила скорой помощи следующие:
при термическом ожоге кожу обрабатывают спиртом или свежеприготовленным раствором перманганата калия, а затем смазывают мазью от ожогов или присыпают танином;
при химических ожогах глаз обильно промывают глаза водой, используя глазную ванночку, после этого следует обратиться к врачу;
при ожогах кислотой необходимо омыть реактив большим количеством воды, затем обработать кожу растворам соды;
при ожогах щелочью необходимо смыть реактив большим количеством воды, затем промыть участок кожи разбавленной уксусной кислотой, а затем снова водой.
Прежде чем приступить к эксперименту, студенты должны изучить соответствующий раздел учебника, лекций, а также ознакомиться с описанием работы и ответить на вопросы для самоподготовки.
С правилами поведения в химической лаборатории и техникой безопасности ознакомилась(ся)
Фамилия _____________________ Имя_________________ Отчество _______________________
Дата: Подпись:
_____._____20____ ____________________
Занятие 1. Дата ____.____. 20___
Тема : Способы выражения состава растворов. Приготовление растворов. Теоретический материал к занятию:
Эквивалент – это реальная или условная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции одному электрону.
Массовая
доля растворенного вещества
![]()
Х – растворенное вещество
Молярная концентрация,
![]()
Молярная
концентрация эквивалента 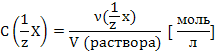
Фактор
эквивалентности, ![]()
Молярная
масса эквивалента, ![]()
Плотность
раствор, ![]()
Моляльная
концентрация, ![]()
Формулы перехода от одних способов выражения состава раствора к другим
Обозначение |
(Х) |
с(Х) |
сm(X) |
Массовая доля (Х)
|
|
с(Х) М(Х) 1000 |
____с(Х) М(Х)______ 1000 + с(Х) М(Х) |
Молярная концентрация с(Х), моль/л
|
(Х) 1000 М(Х) |
с |
сm(X) 1000 1000 + сm(Х)М(Х) |
Моляльная концентрация сm(X), моль/л
|
1000 (Х)__ (1 - (Х)) М(Х) |
___1000 с(Х)__ 1000 с(Х)М(Х) |
сm |
Задача.
Какой объем соляной кислоты (ρ=1,070 г/мл) и воды необходим для приготовления раствора HCl объемом 200 мл и молярной концентрацией 0,1 моль/л для кислотно-основного титрования натрия тетрабората.
Дано |
Решение |
V (р-р) =200 мл = 0,2 л С (HCl) = 0,1 моль/л ρ (р-р) = 1,07 г/мл М (HCl) = 36,5 г/моль _____________________ m ( р-р HCl) и V (H2O) = ?
|
(m (р-р HCl) – неизвестна) |
2. Массу исходного раствора HCl можно рассчитать по формуле :
m (p-p HCl) = m (HCl) / V (HCl) (m (HCl) и V (HCl) – неизвестны)
3. Массовую долю ω можно найти в справочнике, зная плотность ρ исходного раствора HCl. Массу HCl можно рассчитать зная молярную массу вещества и количество вещества
m (HCl) = M (HCl) · n (HCl) (n (HCl) – неизвестно)
4. Количество вещества HCl можно рассчитать зная объем раствора и его концентрацию
n (HCl) = V (p-p) · C(HCl) (обе величины даны в условии задачи)
4.1 n (HCl) = 0,2 л · 0,1 моль/л = 0,02 моль
4.2 m (HCl) = 36,5 г/моль · 0,02 моль = 0,73 г
4.3 ω (%) = 14% или ω (в долях) = 0,14 (по таблице №14)
4.4 m (p-p HCl) = 0,73 г / 0,14 = 5,2 г
4.5 V (р-р HCl) = 5,2 г / 1,07 г/мл = 5мл
4.6 V(H2О) = 200 мл - 5 мл = 195 мл
