
- •Пептидергическая регуляция гомеостаза
- •Глава 1
- •1.2.2. Цитомедины
- •Литература
- •1. Анисимов в. Н., Данецкая е. В., Морозов в. Г., Хавин-
- •Глава 2
- •Литература
- •Глава 3
- •3.2. Возрастная динамика выработки свободных радикалов и функционированирование антиоксидантной системы организма
- •Самцов крыс [2]
- •3.3. Участие пептидов
- •Литература
- •Глава 4
- •4.2. Нейрогормоны и регуляторные пептиды в функционировании центральной нервной системы при нейродегенеративных заболеваниях
- •4.3. Перспективы изучения нейрогормонов
- •Литература
- •Глава 5
- •5.4. Перспективы использования пептидов
- •Литература
- •Глава 6
- •Литература
- •Глава 7
- •Литература
- •Глава 1. Пептидергаческая регуляция гомеостаза 9
- •Глава 2. Пептиды и система иммунитета 39
- •Глава 3. Роль пептидов в свободнорадикальном окислении и
- •Глава 5. Модулирующее действие пептидов при нарушении
- •Глава 6. Пептиды и радиационное излучение 124
- •Глава 7. Роль и значение пептидов в механизмах ангиогенеза и
- •199034, Санкт-Петербург, Менделеевская лин., 1
Глава 6
ПЕПТИДЫ И РАДИАЦИОННОЕ ИЗЛУЧЕНИЕ
6.1. Теоретические предпосылки
На основании многочисленных экспериментальных исследований и клинических наблюдений к настоящему времени сформировались представления о том, что острая лучевая болезнь развивается в виде системной реакции организма в ответ на ионизирующее излучение и слагается из комплекса изменений, протекающих в определенной последовательности [9]. При этом степень тяжести лучевой патологии и патогенез лучевой болезни во многом определяется поражением нескольких «критических» систем организма [4, 8, 10, 22]. К наиболее радиочувствительным критическим системам относятся органы лимфопоэза и кроветворения: тимус, лимфатические узлы, костный мозг и селезенка. Лучевое поражение этих органов в диапазоне доз от 1 до 10 Гр общего однократного равномерного рентгеновского или гамма-излучения и присоединяющиеся инфекционные осложнения являются ведущими звеньями в патогенезе костномозгового синдрома. Второй «критической» системой клеточного обновления, определяющей особенности острой лучевой болезни при действии летальных доз ионизирующих излучений, является кишечный эпителий. В связи с этим в классификации острой лучевой болезни выделяется так называемый «кишечный синдром» или «кишечная» форма этого заболевания. В типичной форме «кишечный синдром» формируется в диапазоне доз от 10 до 100 Гр общего равномерного рентгеновского или гамма-облучения, при этом поражение тонкого кишечника становится основным синдромом в клинической и патологоанатомической картине, который приводит к гибели облученных животных на 3—5 сут. Патогенез в этом случае обусловлен ранней гибелью кишечного эпителия, обезвоживанием и потерей электролитов,
124
развитием бактериемии и всасыванием из кишечника токсических продуктов [4, 11, 12]. По данным ряда авторов, из различных отделов желудочно-кишечного тракта наиболее радиочувствительными являются проксимальные отделы двенадцатиперстной и тощей кишки.
Анализ данных радиобиологических и патоморфологиче-ских исследований свидетельствует о том, что основные события, определяющие летальный исход организма при «кишечном синдроме», развиваются в ранние сроки после облучения, а восстановление эпителиальной выстилки зависит от числа сохранившихся стволовых клеток и скорости их пролиферации. Обращает внимание раннее развитие сосудистой реакции в слизистой оболочке органов желудочно-кишечного тракта при действии ионизирующего излучения. Патомор-фологическая картина нарушения гемодинамики и развития геморрагического диатеза, характерная для периода первичных и ранних реакций острой лучевой болезни, в целом достаточно хорошо изучена. Обычно нарушение микроциркуляции в облученных тканях относят к ранним функциональным реакциям вазомоторного типа. Вместе с тем прослеживается отчетливая взаимосвязь между накоплением в органах, подвергнутых лучевому воздействию, вазоактивных субстанций, изменением чувствительности артериол, венул и капилляров к адреналину, гистамину, серотонину и аце-тилхолину, повышением проницаемости сосудистой стенки и формированием межуточного отека [2]. Результаты исследований последних лет позволили установить, что ионизирующая радиация инициирует высвобождение из клеток биогенных аминов, которые в свою очередь запускают механизм ранних морфофункциональных сосудистых реакций [16, 33]. Эти реакции становятся одним из ведущих патогенетических факторов, усиливающих первоначальные повреждения клеток и тканей, поскольку одновременное высвобождение разных по механизмам действия вазоактивных аминов и их локальное накопление в ткани способствуют развитию микро-циркуляторного шока и гипоксии.
Установлено, что к числу наиболее радиочувствительных клеток относятся также тучные клетки [30, 48], а тучнокле-точная реакция является частью системного ответа организма на ионизирующее излучение. В норме эти клетки являются одним из постоянных компонентов соединительной ткани. Их предшественники образуются в костном мозгу, мигрируют через кровоток и дифференцируются в зрелые тучные клетки под контролем локальных факторов микроок-
125
ружения, в том числе лимфокинов сенсибилизированных Т-лимфоцитов [26, 28, 41, 43]. В гранулах тучных клеток содержатся сульфатированные протеогликаны, различные медиаторы, включая пептиды, гистамин, серотонин (у грызунов) и др. Эти клетки обладают способностью не только синтезировать биогенные амины, но и поглощать их из окружающей среды, что может служить отражением участия их в регуляции содержания свободных аминов в ткани [5]. Кроме того, в тучных клетках выявлен целый спектр мультифункци-ональных цитокинов, которые принимают непосредственное участие в регуляции ряда физиологических, иммунологических и патологических функций [27]. В последние годы большое внимание уделяется морфофункциональным взаимоотношениям между тучными клетками и нервными волокнами в слизистой оболочке желудка и кишечника [49]. Предполагается, что эти связи отражают один из механизмов нейроим-мунной регуляции транспорта электролитов в кишечнике [36].
Существуют веские доказательства тому, что в диапазоне доз от 6 Гр и выше кишечный синдром накладывается на ра-диационно-индуцированную супрессию костного мозга и животные гибнут в период «кишечной фазы» не только от поражения кишечного эпителия и обезвоживания, но также от анемии и развивающихся инфекционных осложнений [23, 37, 50]. Кроме того, в ряде исследований показано, что на выживаемость животных могут влиять и другие факторы. Так, в реализации опосредованных эффектов ионизирующего излучения определенную роль играют металлотионеины (МТН) [38—40]. МТН представляют собой семейство низкомолекулярных металлсвязывающих белков, различающихся природой и количеством хелатированных ионов металлов и локализованных в цитоплазме и клеточном ядре. Установлено, что МТН участвуют в депонировании и метаболизме необходимых (Zn, Си, Мп и др.) и элиминации тяжелых металлов (Cd, Pb, Hg и др.) [21]. По современным представлениям, МТН являются белками «острой фазы» и повышают устойчивость организма как к воздействию радиации, так и химических токсикантов. МТН участвуют в терминации свободно-радикальных реакций, генерируемых различными воздействиями, и выступают в качестве одного из элементов неспецифической защиты клеток от кластогенных факторов.
Таким образом, следует подчеркнуть, что в основе «кишечного синдрома» лежит высокая радиочувствительность
126
процесса обновления кишечного эпителия. Наряду со снижением пролиферативного потенциала стволовых клеток и «барьерной» функции энтероцитов, в механизме лучевых реакций немаловажное значение имеет повреждение сосудистых и стромальных элементов, нарушение нейрогормональ-ных звеньев регуляции, а также поражение гемопоэтической и иммунной системы. Поскольку в настоящее время желудочно-кишечный тракт рассматривают в качестве одного из наиболее значительных органов, содержащих клетки ДНЭС, которые вырабатывают многие жизненно важные гормоны, и, тем самым, участвующие в формировании общего гоме-остаза организма [6], то компенсаторно-приспособительные и патологические процессы, протекающие в кишечнике, неизбежно сказываются на деятельности других органов и систем организма.
В настоящее время для лечения острой лучевой болезни применят комплексные терапевтические мероприятия [2, 12, 23]. Эти мероприятия направлены на купирование продромального синдрома, предупреждение развития геморрагического синдрома и инфекционных осложнений. В курс лечения входят детоксикационные и гемостимулирующие средства, витаминные препараты и биостимуляторы, усиливающие регенерацию, гастрокины и десенсибилизаторы. Одним из перспективных направлений является иммунотерапия лучевой болезни. Так, в эксперименте получены результаты, демонстрирующие широкие возможности гомо- и гетерологических иммуноглобулинов для ослабления лучевого поражения организма [3]. Результаты экспериментального и клинического изучения показали перспективность применения пептидных препаратов, полученных из иммуно-компетентных органов животных, для профилактики и лечения радиационных иммунодефицитов [14]. Тем не менее большинство авторов отмечают, что эффективных методов лечения кишечного синдрома нет. Определенные надежды возлагают на простагландины, интерлейкины и тканевые факторы роста, способные активировать пролиферативную активность стволовых клеток кишечного эпителия [29, 35, 45, 46, 54].
В данной главе изложены результаты изучения действия синтезированных в Санкт-Петербургском институте биорегуляции и геронтологии СЗО РАМН двух пептидных биорегуляторов — вилона и эпиталона — на клеточную репарацию тимуса, селезенки, слизистой оболочки кишечника и пинеа-льной железы после радиационного воздействия.
127

Работа выполнена на самцах белых крыс линии Вистар массой 90—100 г. Испытания проведены на шести группах животных. Контрольную группу составили 6 необлученных крыс, еще 6 необлученным крысам вводили вилон (2-я группа) или эпиталон (3-я группа) — по 3 крысы в каждой группе — в том же режиме, что и облученным животным. Часть животных (я = 30) подвергали однократно общему гамма-облучению в дозе 6 Гр на кобальтовом аппарате ГУБ 2 0 000 при мощности дозы 200 рад/мин. После облучения 12 крысам регуляторные пептиды не вводили (4-я группа), 12 и 6 крысам вводили вилон (5-я группа) и эпиталон (6-я группа) соответственно в разовой дозе 5 мкг/кг внутрибрю-шинно через сутки в течение 5 сут начиная со 2 сут после облучения.
Действие вилона, эпиталона и сочетанного действия гамма-излучения и исследуемых препаратов изучали на препаратах тимуса, селезенки, проксимального отдела двенадцатиперстной кишки и пинеальной железы. Органы выделяли под нембуталовым наркозом через 3 сут после окончания введения препаратов и на 8-е сут после гамма-облучения. Кусочки органов фиксировали 24 ч в кислой жидкости Буэна и в смеси Карновского для электронной микроскопии. Обезвоженный материал заливали в парафин и эпон соответственно. Парафиновые срезы толщиной 7 мкм помещали на предметные стекла, покрытые пленкой из по-ли-Ь-лизина («Sigma»). Ультраструктурные исследования проводили в электронном микроскопе JEM-100S («JEOL», Япония) на ультратонких срезах, контрастированных урани-лацетатом и цитратом свинца.
Общую гистологию органов изучали на срезах, окрашенных гематоксилином и эозином. Для иммуноокрашивания пролиферирующих клеток использовали мышиные моно-клональные антитела к пролиферативному клеточному ядерному антигену — PCNA (Proliferating Cell Nuclear Antigen) при разведении 1 : 50 (клон PC 10, Calbiochem) и авидин-био-тин-пероксидазный набор для выявления мышиных иммуноглобулинов (Vectastain). Серотонинположительные клетки выявляли с помощью поликлональных кроличьих антител к серотонину и биотин-стрептавидин-пероксидазного набора (BioGenex). Ig-содержащие клетки идентифицировали набором для выявления крысиных иммуноглобулинов (BioGe-
128
Рис. 2. Влияние пептидов вилона, тимогена и эпиталона на экспрессию ядерной и митохондриальной ДНК.


а—г — иммуногистохимическая реакция ядер клеток с антителами к
PCNA. Метод авидинбиотин-пероксидазного комплекса, диаминобензидин,
ув. х 175; д—ж — селективное окрашивание тучных клеток толуидиновым
синим при рН 0.5, ув. х 175.
Рис. 5. Пролиферативная активность и иммуноглобулинпродуци-рующие клетки в селезенке крыс в контроле (а, д), на фоне действия эпиталона (б), на 8-е сутки после у-облучения (в, е) и на
фоне действия вилона после у-облучения (г, ж). ЛФ — лимфоидные фолликулы; ЗЭК — зоны экстрамедуллярного кроветворения; а—г — иммуногистохимическая реакция ядер клеток с антителами к PCNA. Метод авидин-биотин-пероксидазного комплекса, диаминобензидин, хув. 175; д—ж — иммуноглобулинсодержащие клетки. Метод биотин-стрептавидин-пероксидазного комплекса, диаминобензидин,
ув. х 175.

--"■"""■*"." ""'■"■ г -Z~.. -$к~~ .■ ■ • Зг1
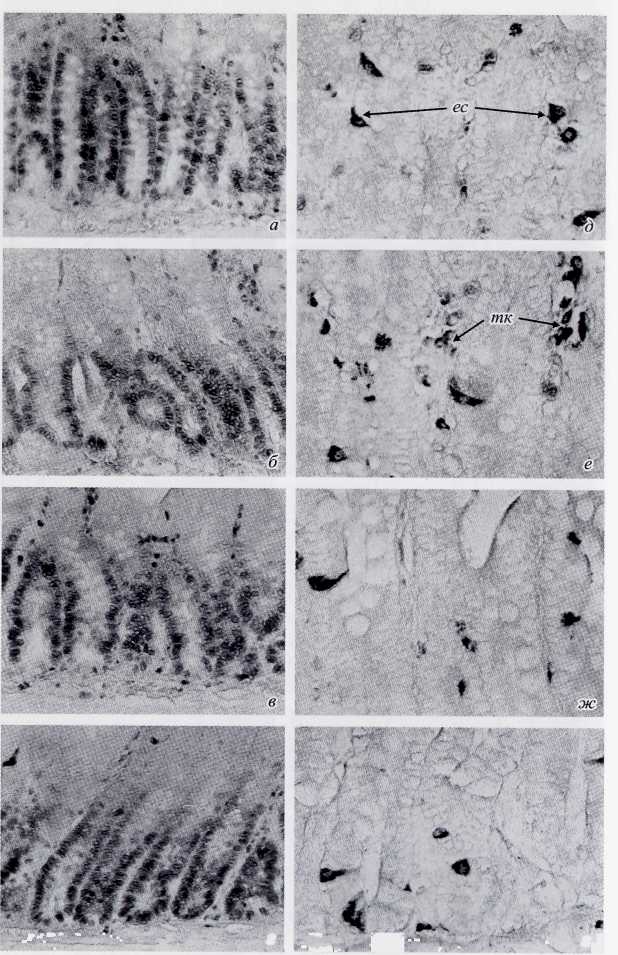
Рис. 6. Пролиферативная активность и серотонинсодержащие клетки в двенадцатиперстной кишке крыс в контроле (а, д), на фоне действия эпиталона (б, е), на 8-е сутки после у-облучения
(в, ж) и на фоне действия вилона после у-облучения (г, з). ЕС — энтерохромаффинные клетки; ТК— тучные клетки, а—г — иммуногистохимическая реакция ядер клеток с антителами к PCNA. Метод ави-дин-биотин-пероксидазного комплекса, диаминобензидин, ув. х 175; д—з — иммуногистохимическая реакция на серотонин. Метод биотин-стрептавидин-пероксидазного комплекса, диаминобензидин, ув. х 350.
Рис. 8. Функциональная морфология саркомы М-1 в контроле. ас — соединительнотканная капсула, кс — кровеносные сосуды, an — апоптоз, мит — митоз опухолевых клеток, тк — тучные клетки, а — окрашивание гематоксилином и эозином, ув. х 240; б — полутонкий срез, ув. х 480; в — иммуногистохимическая реакция ядер клеток с антителами к PCNA (стрелками показаны PCNA-позитивные ядра эндотелиальных клеток); метод авидин-биотин-пероксидазного комплекса диаминобензидин, ув. х 480; г — окрашивание на апоптоз по Мозеру, ув. х 480; д — концентрация тучных клеток в подкожной клетчатке над опухолью, окрашивание толуидиновым синим при рН 0.5, ув. х 240; е — ядрышковые организаторы в опухолевых клетках, селективно окрашенные методом AgNOR, ув. х 10 000.


а — введение вилона с 1-х по 10-е сут роста саркомы, ув. х 4200; б — введение вилона с 12-х по 21-е сут, ув. хбЮО.
Рис. 10. Ангиогенез в подкапсульной зоне саркомы М-1 после инъекций вилона в разовых дозах 5 мкг.
а — введение вилона с 1-х по 10-е сут, окрашивание гематоксилином и эозином, ув. х 3500; б — введение вилона с 12-х по 21-е сут, полутонкий
срез, ув. х 240.

Рис. 11. Действие эпиталона на морфологию саркомы М-1.
кс — кровеносные сосуды, нп — некроз паренхимы, on — апоптоз, о/с —
опухолевая клетка, а — окрашивание гематоксилином и эозином, ув. х 120:
б — иммуноокрашивание на PCNA (стрелками показаны PCNA-позитив-'
ные ядра эндотелиальных клеток), ув. х 480; в — импрегнация на апоптоз
по Мозеру, ув. х 480; г — тучная клетка (тк) интратуморального типа,
ув. х 10 000.
пех). Для выявления МТН-положительных клеток применяли кроличьи антитела к металлотионеинам (1: 2000), полученные в лаборатории экспериментальной ядерной медицины МРНЦ РАМН и ранее протестированные нами на операционном клиническом материале [47]. Иммуногисто-химическое выявление антигенов на гистологических срезах выполнено согласно основным требованиям для иммунопе-роксидазных методов [7, 13, 34,44]. Тучные клетки селективно окрашивали 1%-ным раствором толуидинового синего (Fluka) в 0.5 М НС1 при рН 0.5 [24, 49].
Морфометрические исследования выполнены с помощью системы компьютерного анализа микроскопических изображений IMSTAR с применением прикладных лицензионных программ Morphostar-2 и Colquant-2, согласно основным принципам стереологии в морфометрии [1, 53]. В работе использовались следующие стереологические параметры и их размерности: АТ — общая тестируемая площадь (мм2); Ns — общее число сечений структур на Ат; N{ = NS/AT — количественная плотность (число сечений структур i на единицу площади среза); Aj (суммарная площадь сечений структур i на Aj (мм2); р,н = Af/Aj — объемная плотность структур i (интегральный показатель содержания структур в объеме ткани, %); OpDj — оптическая плотность интенсивности иммуногисто-химического окрашивания структур i на срезе (относительные единицы).
Для изучения пролиферативной активности клеток определяли митотический индекс (/мит) и пролиферативный показатель по PCNA (/PCna)' 4cna определяли как отношение количественной плотности PCNA-положительных ядер к количественной плотности ядер клеток, окрашенных гематоксилином. Для каждого животного подсчет соответствующих структур проводили в 10—15 тестовых полях по трем срезам исследуемого органа. /мит и /PCNA в двенадцатиперстной кишке определяли в 10—15 сечениях крипт с общим содержанием в них не менее 1000 ядер энтероцитов. Тестовые площади для определения всех остальных показателей составляли не менее 3 мм2. Для статистической обработки полученных результатов использовали непараметрический ^/-критерий Ман-на-Уитни.
5 Зак. №4312
129
6.3. Влияние пептидов на клеточную репарацию в различных органах после облучения
6.3.1. Функциональная морфология органов у интактных животных
Вилочковая железа (тимус)
Гистологический рисунок вилочковой железы животных контрольной группы соответствует вариантам нормы. Тимус имеет дольчатое строение с дифференциацией долек на корковое и мозговое вещество. От капсулы органа внутрь ткани отходят тонкие соединительно-тканные перегородки, делящие вилочковую железу на дольки. Прослойки соединительной ткани (септы) содержат мелкие кровеносные сосуды. Периферическую часть долек тимуса занимает кора, центральную — мозговое вещество. В наружной части коркового вещества, прилежащей к соединительно-тканным перегородкам, имеется несколько слоев лимфобластов. Там же можно видеть делящиеся клетки. Внутри коркового слоя находятся, главным образом, малые неделящиеся лимфоциты, расположенные между эпителиальными клетками. Эпителиальные клетки в корковом слое звездчатой формы за счет длинных и тонких цитоплазматических отростков. В мозговом веществе лимфоцитов существенно меньше, а клеточный состав представлен в основном эпителиальными клетками. Небольшие группы эпителиальных клеток с крупным светлым ядром и пылевидным хроматином местами формируют плотные концентрические образования — тимические тельца, которые преимущественно представлены в зонах кортико-медулляр-ного сочленения. По данным электронной микроскопии, эпителиальные клетки тимуса имеют выраженные отростки, соединяющиеся друг с другом путем десмосом и образующие сеть, в которой располагаются клетки лимфоидного ряда. Ультраструктура эпителиальных клеток варьирует. Одни клетки имеют ядра неправильной формы, хроматин пониженной электронной плотности с узким ободком маргинальной конденсации и ядрышко с хорошо выраженной фибриллярной структурой. В цитоплазме обнаруживаются митохондрии, умеренное количество свободных рибосом, диффузно рассеянные пузырьки, элементы гранулярной и агранулярной эндоплазматической сети, встречаются также волокнистые структуры и тонофибриллы. Другие, более темные эпителиальные клетки несколько удлиненной формы,
130
ядра продолговатые, с широкой зоной уплотненного хроматина. В цитоплазме выявляются многочисленные свободные эибосомы, светлые митохондрии, параллельные цистерны гранулярной эндоплазматической сети (ГЭС), пластинчатый комплекс, пузырьки гладкого эндоплазматического ретику-лума и небольшое число миелиновых фигур. Для лимфобластов характерно округлое ядро, иногда с выемками, и сетчатое ядрышко. Мелкозернистый эухроматин распределен в кариоплазме более или менее равномерно. Гетерохроматин сконцентрирован по краю ядерной мембраны в виде узкого ободка. В цитоплазме много свободных рибосом, которые иногда объединяются в полисомы. ГЭС развита слабо и представлена лишь несколькими плоскими цистернами. Митохондрии крупные, круглой или овальной формы, с развитой системой крист. Комплекс Гольджи состоит из небольшого числа мелких и крупных пузырьков. Иногда в цитоплазме обнаруживаются электронно-плотные осмиофильные гранулы, окруженные однослойной мембраной. Для малых лимфоцитов характерно крупное овальное ядро, окруженное тонким ободком светлой мелкозернистой цитоплазмы. Хроматин распределен по всему ядру в виде небольших скоплений или образует более крупные агрегаты, прилегающие к ядерной мембране. Нередко в ядре обнаруживается ядрышко, окруженное конденсированным хроматином. В цитоплазме содержатся свободно лежащие рибосомы, Единичные округлые или слегка удлиненные митохондрии рассеяны по всей цитоплазме. Элементы эндоплазматической сети выражены слабо. Пластинчатый комплекс, как правило, редуцирован. На препаратах, окрашенных гематоксилином, насыщенность корковой зоны по ядрам составляет более 29 000 тимо-цитов на 1 мм2 площади среза. Основная популяция клеток с PCNA-положительными ядрами располагается в корковом веществе (рис. 4, a). /PCNA в корковом веществе составляет 26 %. В мозговом веществе реакцию на PCNA дают единичные ядра. При окрашивании толуидиновым синим в прослойках соединительной ткани, разделяющих дольки, визуализируются немногочисленные тучные клетки (рис. 4, д).
Селезенка
На гистологических препаратах селезенки контрольных животных прослеживается характерная микроскопическая структура этого органа. Снаружи селезенка покрыта тонкой
131
соединительно-тканной капсулой, от которой вглубь органа отходят тяжи — трабекулы. Между трабекулами располагается паренхима, состоящая из белой и красной пульпы. Белая пульпа представлена совокупностью лимфоидных периарте-риальных муфт и фолликулов округлой формы. В герминативных центрах фолликулов, являющихся основным местом образования В-лимфоцитов, позитивную реакцию на PCNA разной степени интенсивности иммуноокрашивания дают практически все ядра (рис. 5, а). Их количественная плотность составляет 8082±79 на 1 мм2. Красная пульпа образуется из пульпарных тяжей и венозных синусов. В норме у крыс селезенка представляет собой гематопоэтический орган экстрамедуллярного кроветворения, поскольку в ней образуются клетки не только лимфоидного, но и эритроидного и гранулоцитарного ряда, а также мегакариоциты. При имму-ноокрашивании на PCNA в субкапсулярной зоне и вдоль трабекул выявляются небольшие по размерам очаги миело-идного кроветворения с высокой интенсивностью окрашивания PCNA-положительных ядер (рис. 5, а). В этих зонах на 1 мм2 выявляется более 2000 активно пролиферирующих клеток.
Известно, что наряду с другими лимфоидными органами, лимфоидная ткань селезенки принимает активное участие в иммунных реакциях гуморального типа. В свою очередь основную массу сывороточных антител (70—80 %) составляют IgG. Их продуцентами являются плазматические клетки, образующиеся из активированных В-лимфоцитов. По данным иммуногистохимии, Ig-позитивные клетки выявляются практически по всей паренхиме селезенки с концентрацией по периферии маргинальных зон и в виде характерных цепочек вдоль трабекул (рис. 5, д). Количественная плотность Ig-продуцирующих клеток составляет более 700 на 1 мм2 площади среза селезенки. Тучные клетки в селезенке практически не идентифицируются.
Двенадцатиперстная кишка
На поперечных срезах двенадцатиперстной кишки рельеф слизистой оболочки создают в основном ворсинки и крипты. У интактных животных ворсинки имеют различную форму, но чаще встречается пальцевидные и листовидные. Поверхность ворсинок выстлана призматическими каемчатыми эн-тероцитами и бокаловидными клетками. Ядра энтероцитов
132
ворсинок имеют овальную форму, интенсивно окрашиваются и располагаются в базальной части клеток. Крипты выстланы однослойным призматическим эпителием. В дне крипт можно различить небольшое количество апикально-зернистых клеток (клеток Панета) с характерной оксифиль-ной зернистостью над ядром, расположенным в базальной части клетки. В стенке крипт встречаются цилиндрические и слизистые клетки со светло окрашенной цитоплазмой. Основу ворсинок образует собственная пластинка слизистой оболочки, которая представлена рыхлой волокнистой соединительной тканью.
При электронно-микроскопическом изучении каемчатые (всасывательные) энтероциты на апикальной поверхности имеют типичные микроворсинки с хорошо выраженным гли-кокаликсом. В их цитоплазме присутствуют митохондрии овальной или округлой формы. Свободные рибосомы и полисомы обнаруживаются в небольшом количестве. Уплощенные профили гладкой эндоплазматической сети (ГЭС) выявляются в надъядерной зоне цитоплазмы и вокруг митохондрий. Агранулярная эндоплазматическая сеть развита слабо. Элементы комплекса Гольджи представлены в умеренном количестве и локализуются над ядром. В цилиндрических клетках, лежащих у основания ворсинок, хорошо развиты цистерны ГЭС и вакуоли пластинчатого комплекса. Встречаются два типа бокаловидных клеток. Для первого типа характерен хорошо развитый аппарат Гольджи и растянутые апикальные отделы цитоплазмы, содержащие большое количество слизистых вакуолей. В бокаловидных клетках другого типа, количество которых в ворсинке невелико, в слизистых вакуолях содержатся мелкие электронно-плотные гранулы. Ультраструктурный вид клеток эпителия кишечных крипт зависит от глубины их расположения. В основании крипт выявляются клетки Панета с характерными крупными секреторными гранулами и мелкие цилиндрические клетки. Цитоплазма последних содержит незначительное количество митохондрий и компонентов ГЭС, а также небольшой аппарат Гольджи. Количество свободных рибосом в этих клетках очень велико.
Энтероэндокринные клетки крипт и ворсинок характеризуются узкой апикальной частью и широким основанием, заполненным нейроэндокринными секреторными гранулами, форма, размеры и внешний вид которых зависит от типа гормона, секретируемого эндокринной клеткой. Чаще всего встречаются энтерохромаффинные клетки с характерными
133
полиморфными, бобовидной формы гранулами со средним диаметром 200—350 нм. Как известно, эти клетки продуцируют серотонин, мелатонин, мотилин и субстанцию Р [6]. Гораздо реже при электронно-микроскопическом исследовании встречаются эндокринные клетки с гранулами разных размеров, характерными для соматостатина (круглые, матрикс мелкозернистый, умеренно осмиофильный, размер гранул — 200—350 нм), секретина (электронно-плотные, часто неправильной формы, 100—200 нм) и холецистокинина (круглые, электронно-плотные, диаметром 200—250 нм). В подслизистом слое встречается большое количество тучных клеток (мастоци-тов) с круглым ядром и характерными крупными округлыми секреторными гранулами в базальной части клеток.
Известно, что эпителий слизистой оболочки кишечника находится в состоянии постоянного обновления, основу которого составляет пролиферация стволовых и дифференцирующихся клеток генеративной зоны (см. рис. 6, а). Высокий индекс PCNA (44.8 %) и митотический индекс (2.9 %) отражают уровень физиологической регенерации эпителия двенадцатиперстной кишки животных 1-й группы. По современным представлениям, регуляция функций пищеварительной системы представляет очень сложный процесс, в котором наряду с классической вегетативной системой, участвуют пептидергическая иннервация и широкий спектр физиологически активных гормонов и медиаторов, продуцируемых клетками ДНЭС [18]. Одним из ключевых посредников химической информации в организме, выполняющих роль как гормона, так и нейротрансмиттера, является серотонин. Этот биогенный амин обладает выраженным вазоактив-ным действием, принимает участие в регуляции моторики желудочно-кишечного тракта и секреции слизи. В последние годы получены убедительные данные о том, что серотонин является митогенным агентом и может регулировать проли-феративную активность эпителиальных, эндотелиальных и лимфоидных клеток [31,42, 51]. Установлено, что около 90 % эндогенного серотонина содержится в желудочно-кишечном тракте, где он в основном синтезируется и накапливается в энтерохромаффинных клетках [25] и является основным источником экстрапинеального мелатонина [32]. Кроме того, ранее проведенные нами исследования показали, что в диапазоне сублетальных—летальных доз поведение всей популяции эндокринных клеток в разных отделах желудка и кишечника определяется реакцией на облучение энтерохромаффинных клеток [19].
134
Проведенные в данной работе иммуногистохимические исследования показали, что в двенадцатиперстной кишке позитивную реакцию на серотонин дают энтерохромаффин-ные клетки (ЕС-клетки), локализующиеся в эпителиальном слое крипт и ворсинок, а также часть тучных клеток в собственной пластинке слизистой оболочки (рис. 6, д). Около 80 % ЕС-клеток располагаются в криптах, а ббльшая часть серото-нинположительных тучных клеток локализуется в собственной пластинке ворсинок. Дифференциальный анализ показал, что суммарная объемная плотность клеток с позитивной реакцией на серотонин в криптах составляет 0.64 % при количественной плотности ЕС-клеток 162 на 1 мм2 площади слизистой оболочки. Тучные клетки в двенадцатиперстной кишке, селективно окрашенные толуидиновым синим, топографически располагаются субэпителиально, а также концентрируются вблизи кровеносных и лимфатических сосудов. Их суммарная количественная плотность в собственной пластинке ворсинок и крипт у контрольных животных соответствует 169 клеткам на 1 мм2 площади среза.
При иммуногистохимическом тестировании исследуемых органов на металлотионеины отчетливая позитивная реакция была зарегистрирована только в двенадцатиперстной кишке. Металлотионеинположительные клетки располагаются преимущественно в основании крипт, имеют пирамидальную форму и гистотопографически соответствуют клеткам Панета. Иммунореактивный продукт в них полностью заполняет цитоплазму. У интактных животных в 100 криптах в среднем выявляется 132 МТН-позитивные клетки. Необходимо отметить, что еще в 70-х годах было установлено, что наряду с секрецией в просвет кишечника пищеварительных ферментов, таких как пептидазы и лизоцим, клетки Панета принимают участие в выведении из организма тяжелых металлов [20].
Пинеалъная железа (эпифиз)
Известно, что пинеальная железа находится в многосторонних отношениях с другими эндокринными органами и играет важную роль в регуляции физиологических функций организма. Эта деятельность осуществляется гормональными и пептидными факторами, которые оказывают влияние на функции гипоталамуса, гипофиза, изменяют течение метаболических процессов, нейтрализуют действие гонадо-
135
тропных гормонов [15]. Проведенные нами исследования показали, что у интактных крыс гистологический рисунок пинеальной железы обычный. Пинеалоциты составляют ббльшую часть ткани железы и представлены клетками неправильной формы с длинными цитоплазматическими отростками. Ядра пинеалоцитов овальные или неправильной формы, имеют низкую электронную плотность, кариолемма часто образует инвагинации. В ядре обычно находится одно, реже два ядрышка. Постоянным компонентом цитоплазмы пинеалоцитов является умеренное количество элементов ГЭС. Пластинчатый комплекс хорошо развит и состоит из системы плоских мешочков, связанных со светлыми везикулами. Митохондрии присутствуют в цитоплазме пинеалоцитов в большом количестве. Они варьируют по форме от округлых и овальных до удлиненных и имеют матрикс умеренной электронной плотности. Глиальные клетки легко дифференцируются от пинеалоцитов и присутствуют в ткани эпифиза в значительно меньшем количестве. Эти клетки характеризуются высокой электронной плотностью цитоплазмы, неправильной формой ядра с выраженной краевой конденсацией хроматина (иногда глыбки конденсированного хроматина располагаются по всему ядру). Клетки имеют длинные цитоплазматические отростки, которые часто вплотную соприкасаются с мембраной близлежащих пинеалоцитов. В глиальных клетках хорошо развит пластинчатый комплекс, присутствует значительное количество митохондрий крупного размера, овальной или округлой формы, часто с просветленным матриксом в центральной части. Постоянным компонентом цитоплазмы являются лизосомы и липид-ные капли. В пинеальной железе крыс имеется также другой тип глиальных клеток, которые являются составной частью безмякотных нервных волокон (так называемые шваннов-ские клетки). Они располагаются иногда в паренхиме органа, но чаще встречаются в широких периваскулярных пространствах, окружающих тонкостенные сосуды, имеющие поры (фенестрированный тип капилляров). Безмякотные нервные волокна, расположенные в эпифизе, тесно контактируют с пинеалоцитами и глиальными клетками или их отростками. В периваскулярных пространствах, помимо безмякотных волокон, имеются также мякотные нервные волокна.
136
6.3.2. Действие вилона и эпиталона на органы необлученных животных
Во 2-й группе животных после инъекций вилона наиболее существенным изменениям подвергается пролифера-тивная активность клеток в тимусе и двенадцатиперстной кишке. Дольки вилочковой железы увеличиваются в размере в основном за счет коркового слоя. По-видимому, корковое вещество становится более широким за счет активной пролиферации кортикальных тимоцитов. Митозы выявляется не только в субкапсулярной зоне, но и в более глубоких отделах коркового вещества. В мозговом веществе увеличивается содержание мелких и средних лимфоцитов. Кроме того, в центральных отделах долек чаще наблюдаются морфологически активизированные эпителиальные клетки с глыбчатым распределением хроматина в ядрах и базофильной цитоплазмой. На ультраструктурном уровне функциональная активизация эпителиальных клеток проявляется умеренной гиперплазией элементов гранулярной эндоплазматической сети, структур пластинчатого комплекса, ростом числа крист в митохондриях и появлением мелких пиноцитозных везикул в цитоплазме. Тимусные тельца многочисленны и в большинстве случаев имеют хорошо визуализируемые и несколько более гипер-хромные ядра клеток. Сосуды вилочковой железы растянуты и полнокровны. В периферических зонах коры возрастает интенсивность иммуноокрашивания на PCNA ядер тимоцитов с формированием характерных микрофолликулярных образований (рис. 4, б). На фоне снижения суммарной клеточной плотности в корковом веществе, обусловленном увеличением содержания более крупных по размеру лимфобластов и снижением количества зрелых тимоцитов, /рс^А возрастает до 37 %. Не исключено, что эти данные отражают влияние вилона на дифференцировку и скорость миграции Т-лимфо-цитов из коркового слоя тимуса в мозговое вещество.
В двенадцатиперстной кишке увеличение индекса PCNA в генерационной зоне крипт всего на 3.4 % сопровождается увеличением в 1.5 раза числа клеток, вступающих в митоз. Все остальные изученные параметры в тимусе, селезенке и кишке остаются в пределах варьирования морфофункциона-льных показателей у животных контрольной группы.
В опыте с введением эпиталона существенных изменений в гистоархитектонике органов на срезах, окрашенных гематоксилином и эозином, и на ультратонких срезах не выявлено. Однако при окрашивании препаратов на PCNA визуа-
137
лизируется снижение интенсивности иммунной реакции пролиферирующих клеток в селезенке (рис. 5, б) и кишке (рис. 6, б). По данным компьютерного анализа, количественная плотность пролиферирующих клеток в селезенке снижается практически в 2 раза как в лимфоидных фолликулах, так и в зонах миелоидного кроветворения (табл. 3). Примечательно, что, несмотря на достоверное снижение в криптах двенадцатиперстной кишки пролиферативного показателя по PCNA, митотический индекс остается на уровне контрольной группы животных. Кроме того, в кишечнике крыс после инъекций эпиталона отмечается тенденция к снижению интегрального содержания серотонинположительных клеток при достоверном снижении интенсивности иммуноокраши-вания ЕС-клеток. В отдельных участках слизистой оболочки усиливается интенсивность иммуноокрашивания тучных клеток на серотонин (рис. 6, в). В тимусе и пинеальной железе крыс, получавших эпиталон, существенных изменений со стороны исследованных параметров не выявлено.
6.3.3. Действие гамма-облучения
В группе облученных животных, не получавших регуля-торные пептиды, на 8-е сут после гамма-облучения из 12 животных выжило 3 крысы. При этом 6 крыс пали в кишечной фазе лучевой болезни на 3—5-е сут. Морфофункциональные показатели в органах крыс, выживших после радиационного воздействия, имеют следующие особенности.
В тимусе отмечены выраженные атрофические изменения. Размеры долек значительно уменьшены. Деление на корковое и мозговое вещество стирается. Соотношение между паренхимой и стромой нарушено в сторону увеличения последней. Строма отечная, с обильной жировой инфильтрацией. Наряду с погибшими лимфоцитами, ядра которых находятся в состоянии кариопикноза и кариорексиса, достаточно часто определяются делящиеся клетки. В тимических тельцах отмечается распад и дегенерация клеток. На ультратонких срезах вилочковой железы в тимоцитах и ретикуло-эпителиальных клетках выявляются альтеративные изменения, характерные для радиационного воздействия: снижение содержания цитоплазматических органелл, отек и деструкция митохондрий, вакуолизация и фрагментация элементов цитоплазматической сети, появление фаго- и аутофаголизо-сом. Количественная плотность клеток в корковой зоне сни-
138
Таблица 3 Количественные характеристики исследованных параметров саркомы М-1 в контроле, после введения вилона и эпиталона (М ±т)
Группа животных |
а(Н) 24) |
а(2К 40) |
Ц]0 24) |
'Лгк 40) |
т (срт) |
|
/PCNA (%) |
/мит (%) |
/ап (%) |
Sxo (мкм2) |
Ряо (%) |
1-я — контроль |
0.27 |
1.34 |
0.64±0.06 |
14.7+1.0 |
37.4±2.3 |
4220±80 |
76.5 + 2.6 |
2.28±0.09 |
0.28+0.03 |
2.70±0.08 |
7.40+0.18 |
2-я — введение вилона |
0.26 |
0.77 |
0.48+0.09 |
9.82+2.2* |
40.5+3.4 |
4080+190 |
75.4+1.7 |
2.29+0.09 |
0.33+0.02 |
2.71±0.11 |
7.38+0.17 |
с 1-х по 10-е сут в до- |
|
|
|
|
|
|
|
|
|
|
|
зе 0.5 мкг |
|
|
|
|
|
|
|
|
|
|
|
3-я — введение вилона |
0.28 |
1.16 |
0.65+0.06 |
13.56±1.63 |
42.3+3.6 |
4136±170 |
76.0+1.9 |
2.43±0.11 |
0.38+0.02 |
2.70+0.05 |
7.34±0.24 |
с 12-х по 21-е сут в |
|
|
|
|
|
|
|
|
|
|
|
дозе 0.5 мкг |
|
|
|
|
|
|
|
|
|
|
|
4-я — введение вилона |
0.26 |
1.22 |
1.08±0.17 |
18.05+2.5 |
35.9+4.2 |
4327±97 |
78.6+1.4 |
2.49+0.14 |
0.43+0.07 |
2.74+0.12 |
7.52+0.33 |
с 1 -х по 10-е сут в до- |
|
|
|
|
|
|
|
|
|
|
|
зе 5.0 мкг |
|
|
|
|
|
|
|
|
|
|
|
5-я — введение вилона |
0.27 |
1.09 |
0.62±0.06 |
11.27+1.5 |
38.9+2.6 |
3986±110 |
79.2±1.1 |
2.56+0.12 |
0.49+0.02 |
2.80±0.07 |
8.22+0.15 |
с 12-х по 21-е сут в |
|
|
|
|
|
|
|
|
|
|
|
дозе 5.0 мкг |
|
|
|
|
|
|
|
|
|
|
|
6-я — введение эпита- |
0.28 |
0.88 |
0.65+0.06 |
10.9±1.2* |
44.9±2.7* |
4230+120 |
74.5±2.7 |
1.89±0.11 |
0.67+0.13* |
2.80+0.03 |
7.38+0.17 |
лона |
|
|
|
|
|
|
|
|
|
|
|
1 Коэффициенты а определены по уравнениям линий тренда, Т— средняя продолжительность жизни животных после прививки опухолей; * р < 0.05 по срав- |
|||||||||||
нению с контролем, остальные обозначения даны в тексте. |
|
|
|
|
|
|
|
|
|||
жена почти в два раза, а PCNA-позитивные ядра сосредоточены преимущественно по периферии редуцированных долек (рис. 4, в). Однако достаточно высокий индекс PCNA (33 %) пролиферирующих клеток в паренхиме и увеличение содержания тучных клеток в строме свидетельствуют о начавшемся периоде пострадиационного восстановления ви-лочковой железы.
При микроскопическом исследовании селезенки облученных животных отмечается существенное снижение содержания лимфоидных клеток и атрофия периартериальных муфт. На месте лимфатических фолликулов часто обнаруживаются скопления погибших, распадающихся лимфоцитов, плазматических и ретикулярных клеток. Стенки сосудов белой пульпы и соединительно-тканные трабекулы отечные, частично гомогенизированы за счет плазматического пропитывания. Красная пульпа умеренно полнокровна. При им-муноокрашивании на PCNA определяется очень низкий уровень пролиферативной активности клеток как в экстрамедуллярных зонах, так и в редуцированных фолликулах (рис. 5, в). Количественная плотность Ig-позитивных клеток также снижена более чем в два раза по сравнению с контролем (рис. 5, е).
На 8-е сутки после гамма-облучения рельеф слизистой оболочки двенадцатиперстной кишки практически полностью восстанавливается и мало отличается от контрольных животных. В криптах кишечника пролиферативный показатель по PCNA возрастает до 46.5 %, а митотический индекс — до 4.2 %. Эти данные свидетельствуют, что восстановление эпителиального слоя слизистой оболочки у выживших животных протекает очень быстро, а пул стволовых клеток кишечного эпителия в этот период находится на стадии гиперрегенерации (рис. 6, в). Гистологическое и электронно-микроскопическое изучение препаратов также указывает на то, что архитектоника эпителиальной выстилки и ультраструктурное строение энтероцитов начинают нормализоваться. Однако численная плотность ЕС-клеток (рис. 6, ж) и МТН-положительных клеток еще не достигает уровня контрольных животных. Содержание тучных клеток в собственной пластинке слизистой оболочки снижено почти в 10 раз. Это соответствует выводам о высокой радиочувствительности тучных клеток слизистых оболочек к действию ионизирующего излучения и очень медленном восстановлении их количества даже при воздействии сублетальных доз [48].
140
В пинеальной железе облученных животных 4-й группы наиболее выраженные ультраструктурные изменения наблюдаются со стороны сосудистого русла. Они проявляются в набухании и отеке эндотелия, его вакуолизации, исчезновении цитоплазматических органелл и пиноцитозных везикул, расширении и разрыхлении периваскулярных пространств. В отдельных пинеалоцитах выявляется отслоение наружного листка кариолеммы, сопровождающееся набуханием и разрушением крист в центральных участках митохондрий и появлением в цитоплазме обширных вакуолей и миелиновых фигур. При этом наблюдается появление лизосом и увеличение количества и размера липидных капель. Как правило, у животных данной группы пинеалоциты содержат одно ядрышко гомогенной структуры.
6.3.4. Действие вилона и эпиталона на органы облученных животных
После инъекций вилона в тимусе, селезенке и двенадцатиперстной кишке облученных животных отмечается активизация восстановительных процессов. В тимусе определяются характерные признаки восстановления гистологического рисунка и соответственно менее выраженные атрофические изменения по сравнению с 4-й группой облученных животных. Размеры долек вилочковой железы увеличиваются. В дольках тимуса отчетливо выражена дифференциация на корковое и мозговое вещество (рис. 4, г). Корковое и мозговое вещество более густо заполнены рети-кулоэпителиальными клетками. По всей территории коркового вещества выявляется большое количество делящихся клеток, а в зоне кортико-медуллярного сочленения и в мозговом веществе появляются группы активизированных эпителиальных клеток с базофильной цитоплазмой. Функциональная активизация эпителиальных клеток тимуса верифицируется и на электронно-микроскопическом уровне. Кроме того, визуально снижается отек стромы и менее выражена жировая инфильтрация. В корковой зоне количественная плотность клеток ниже, чем у животных 4-й группы. Однако за счет высокого содержания PCNA-позитивных ядер, пролиферативный показатель достигает 55 %. По сравнению с животными 4-й группы в селезенке крыс, леченых вилоном, пролиферативная активность в лимфоидных фолликулах увеличивается в 1.6 раза, а в экстрамедуллярных зонах кро-
141
ветворения — в 4 раза. Кроме того, в 1.7 раза возрастает количественная плотность Ig-содержащих клеток (рис. 5, ж).
После введения вилона нормализуется гистологический рисунок крипт кишечника облученных животных (рис. 6, г). При этом индекс PCNA достигает почти 50 %, а митотиче-ский индекс увеличивается до 4.7 %. Количественная плотность ЕС-клеток (рис. 6, з) практически достигает уровня контрольных значений. Прослеживается тенденция к увеличению числа МТН-позитивных клеток в основании крипт. По-видимому, неслучайно в этой группе к контрольному сроку выжило 5 животных, а в кишечной фазе на 4—5-е сут погибло только 3 крысы. При анализе данных обращает на себя внимание лишь незначительное увеличение содержания тучных клеток в слизистой двенадцатиперстной кишки и их выраженная гиперплазия в тимусе (рис. 4, ж).
В настоящее время тучным клеткам отводят исключительно важную роль в поддержании тканевого гомеостаза. По данным литературы, тучные клетки участвуют в иммунных реакциях и регуляции локального кровотока, регулируют содержание свободных моноаминов и способствуют восстановлению соединительной ткани при ее повреждении, вносят вклад в развитие эндотелия и, возможно, принимают участие в регуляции транспорта электролитов в кишечнике [5, 36, 41, 43, 52]..С учетом этого можно считать, что полноценного функционального восстановления слизистой оболочки кишечника в данном периоде времени после облучения еще нет даже у животных, которым вводили вилон. Совершенно иная картина наблюдается в вилочковой железе. Известно, что тучные клетки слизистой оболочки кишечника и соединительной ткани лимфоидных органов относятся к разным популяциям мастоцитов, а их фенотипическая дифференцировка контролируется локальными факторами микроокружения и лимфокинами, продуцируемыми Т-лимфоцитами [26]. В свою очередь в дифференцирующихся тучных клетках начинается экспрессия мРНК, ответственных за синтез целого спектра цитокинов, таких как интерлейкины ИЛ-1, ИЛ-3—ИЛ-6 и ИЛ-8, гамма-интерферон и др. [27, 41]. Эти цитокины аутокринным или паракринным путем влияют на пролиферацию и функционирование как самих тучных клеток, так и других гемо- и лимфопоэтических клеток. Не исключено, что «гиперрегенерация» тучных клеток и тимоцитов у облученных животных после введения вилона может быть обусловлена их взаимно индуктивным влиянием. Кроме того, данный эффект дает основание предположить, что ви-
142
лон может активировать пролиферативную активность выживших после гамма-облучения стволовых клеток костного мозга, являющихся предшественниками Т-лимфоцитов и тучных клеток.
В связи с тем, что в 6-й группе на 8-е сут выжила только одна крыса, провести репрезентативный количественный анализ не представилось возможным. Следует лишь отметить, что после инъекций эпиталона облученным животным 4 крысы погибли в кишечной фазе, а большинство исследованных параметров у выжившего животного находится в диапазоне варьирования данных для облученных крыс 4-й группы. Морфологическое исследование показало, что у этой крысы в тимусе, селезенке и двенадцатиперстной кишке сохраняются патогистологические признаки, обусловленные действием ионизирующей радиации. В то же время, поданным электронной микроскопии, в пинеальной железе выявлялись ультраструктурные признаки, свидетельствующие о повышении функциональной активности клеточных элементов этого органа. На фоне введения эпиталона у облученной крысы в пи-неалоцитах отмечалось увеличение ядерной поверхности за счет возникновения многочисленных глубоких инвагинаций кариолеммы. В цитоплазме увеличивалось количество мембран ГЭС, появлялось множество рибосом. В цитоплазме отдельных пинеалоцитов обнаруживались плотные тельца, ультраструк-турно похожие на нейросекреторные гранулы. В глиальных клетках сохранялись расширенные полости эндоплазматиче-ской сети и отслоение наружной ядерной мембраны. Это явление в глиальных элементах было выражено значительно сильнее, чем в пинеалоцитах, хотя некоторые из клеток глии сохраняли хорошо выраженную ядерную оболочку. Обращало внимание увеличение ядерно-цитоплазматического контакта за счет образования многочисленных неглубоких инвагинаций, а также перераспределение конденсированного хроматина, который располагался не только по периметру кариолеммы, но и по всей площади ядра. В некоторых глиальных клетках отмечалось восстановление крист митохондрий, хотя их матрикс оставался просветленным и набухшим. Как в пинеалоцитах, так и в глиальных клетках, наблюдалось увеличение структурных элементов комплекса Гольджи и снижение содержания ли-пидных капель в цитоплазме.
Результаты комплексного исследования показали, что пептидные биорегуляторы — вилон и эпиталон — обладают разнонаправленными механизмами влияния на течение мор-фофизиологических процессов в изученных органах.
143
Вилон достоверно усиливает пролиферативную активность Т-лимфоцитов, а также повышает пролиферативный потенциал стволовых клеток кишечника. По-видимому, именно этот эффект способствует стимуляции пострадиационного восстановления критических органов. Вместе с тем необходимо учитывать, что поражение лимфоидных органов и кишечного эпителия не является единственным фактором, определяющим лучевую патологию и гибель организма при лучевой болезни. К числу ведущих патогенетических звеньев, усиливающих первоначальные повреждения клеток и тканей, относятся и ранние сосудистые реакции. Микроцир-куляторные нарушения, гипоксия, развитие метаболического ацидоза и другие нарушения обменных процессов в разных клетках, в том числе регуляторах гомеостаза, лежат в основе дезорганизации нейрогуморального регулирования функциональных параметров сосудистой системы [2]. Сложная система регуляции физиологических процессов в исследованных органах предполагает необходимость адекватного пострадиационного восстановления всех морфофункциональ-ных компартментов. Анализ полученных результатов показывает, что в исследуемый период времени после облучения, полной репарации систем, необходимых организму для выживания еще не происходит. В ранее проведенных исследованиях нами было установлено, что стимуляция гемодинамики с помощью низкоинтенсивного лазерного излучения способствует ускорению процессов восстановления висцеральных органов после радиационного повреждения [17]. Причем наибольший терапевтический эффект по восстановлению гистологической структуры радиочувствительных органов, восстановление которых определяется пролиферативным потенциалом стволовых клеток, зарегистрирован при воздействии лазером на симпатические ганглии. При этом в селезенке активировались экстрамедуллярное кроветворение и пролиферация лимфоцитов, а в двенадцатиперстной кишке ускорялся процесс восстановления эпителиальной выстилки. Не исключено, что положительный эффект вилона может потенцироваться в условиях терапевтических мероприятий, направленных на нормализацию нарушенной гемодинамики и микроциркуляции, а также восстановления «барьерной» функции энтероцитов и их способности к детоксикации за счет усиления интенсивности не только пролиферативной, но и внутриклеточной регенерации.
Следует подчеркнуть актуальность дальнейшего изучения вилона, как не только многообещающего иммуномодулиру-
144
ющего средства, но и препарата, стабилизирующего общий гомеостаз и оказывающего стимулирующее действие на про-лиферативные, регенераторные и адаптационные процессы. Это может найти широкое применение в геронтологии для коррекции десинхронозов различной этиологии и патогенеза.
С одной стороны, наиболее объективным регистрируемым действием эпиталона является замедление обменных процессов в слизистой оболочке двенадцатиперстной кишки и снижение активности гемопоэза и лимфопоэза в селезенке. С другой стороны, усиление морфофункциональной активности клеток в пинеальной железе на фоне введения эпиталона после радиационного повреждения, по-видимому, отражает потенциальные репаративные свойства данного пептида к тропному для него органу.
Полученные данные об ингибирующем действии эпиталона на пролиферативную активность клеток свидетельствуют о целесообразности испытания этого пептида в качестве потенциального противоопухолевого препарата.
