
- •Введение
- •1. Строение атома и периодическая система элементов д.И. Менделеева
- •1.1. Строение атома
- •1.2. Квантово - механическое объяснение строения атома
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодическая система элементов д.И. Менделеева и электронная структура атомов
- •1.5. Свойства элементов и периодическая система
- •Вопросы для самоконтроля
- •2. Строение молекул и химическая связь
- •2.1. Ковалентная связь. Метод валентных связей
- •2.2. Гибридизация атомных орбиталей
- •2.3. Ковалентные связи с участием атома углерода
- •2.4. Ионная химическая связь
- •2.5. Металлическая связь
- •2.6. Водородная связь
- •2.7. Поляризация связи и дипольный момент
- •2.8. Основные параметры молекул
- •2.9. Метод молекулярных орбиталей
- •3. Индивидуальные задания для самостоятельной подготовки студентов
- •3.1. Примеры решения типовых задач
- •3.2. Варианты домашних заданий
- •Оглавление
2.2. Гибридизация атомных орбиталей
Изучение таких молекул, как ВеСI2, BCI3 , СН4 , показало, что все связи в них равноценны, несмотря на то, что в образовании их участвуют различные орбитали центрального атома. Слейтер и Полинг объяснили это явление тем, что орбитали различной симметрии, не сильно отличающиеся по энергиям, образуют гибридные орбитали.
Гибридизация - это процесс перераспределения электронных плотностей близких по энергии орбиталей, который приводит к их полной равноценности.
Число гибридных орбиталей равно числу орбиталей, участвующих в гибридизации. Гибридные орбитали более вытянуты в направлении образования химических связей и поэтому обусловливают лучшее перекрывание электронных облаков. По числу участвующих в гибридизации атомных орбиталей различают следующие, наиболее распространенные типы гибридизации: sp -, sр2 - и sр3.
Гибридизация одной s - и одной р -электронных орбиталей приводит к образованию двух гибридных sp - орбиталей (рис. 9).
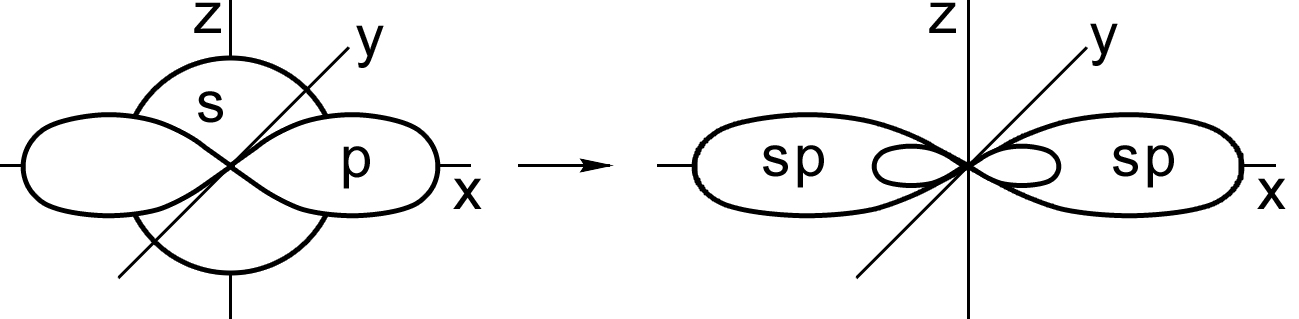
s – орбиталь и p - орбиталь → 2 гибридные sp -орбитали
Рис. 9. Образование sp - гибридных орбиталей
Относительно друг друга две гибридные sp - орбитали расположены под углом 180°, поэтому молекулы с таким видом гибридизации линейны, две связи в них расположены по прямой и противоположно направлены от ядра (рис. 10).

Рис. 10. sp – гибридизация
Гибридизация одной s - и двух р - электронных орбиталей приводит к образованию трех гибридных sр2 - орбиталей. Эти три гибридные орбитали расположены в одной плоскости и направлены в вершины равностороннего треугольника; углы между осями sр2 – гибридных орбиталей составляют 120° (рис. 11).
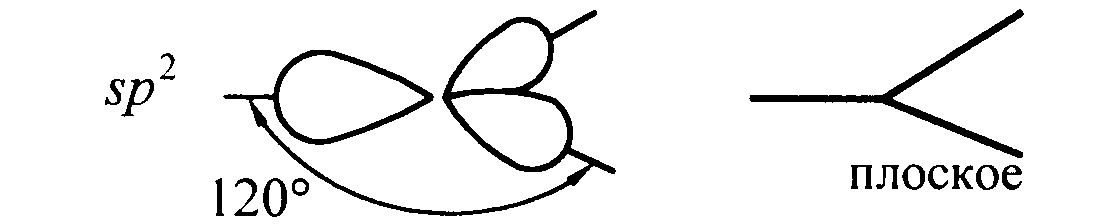
Рис. 11. sp2 - гибридизация

Рис. 12. sp3 - гибридизация
Гибридизация одной s - и трех р - электронных орбиталей приводит к образованию четырех гибридных sр3 - орбиталей. В этом случае четыре гибридные орбитали имеют оси, лежащие в пространстве под углами 109,5о; они направлены к вершинам правильного тетраэдра (рис. 12).
Таким образом, тип гибридизации определяется видом и количеством участвующих в гибридизации электронных орбителей (см. табл.6).
Таблица 6
Типы гибридизации и геометрия молекул
Тип моле-кулы |
Тип гибри-дизации |
Число гибридных орбиталей атома А |
Геометрия молекул |
Валент-ные углы |
Примеры |
АВ2 |
sp (s+p) |
2 |
линейная |
180о |
BeF2, CO2, C2H2 |
АВ3 |
sp2 (s+2p) |
3 |
плоская |
120о |
BCl3, AlF3, C2H4 |
АВ4 |
sp3 (s+3p) |
4 |
тетраэдри-ческая |
109,5о
|
H2O, NH3, SiH4, CCl4, CH4, |
Пример 1. Перекрывание sp – гибридных орбиталей атома бериллия с 1s – АО двух атомов водорода приводит к образованию линейной молекулы гидрида бериллия BeH2; валентный угол H-Be-H в молекуле BeH2 равен 180о (рис. 13 ).
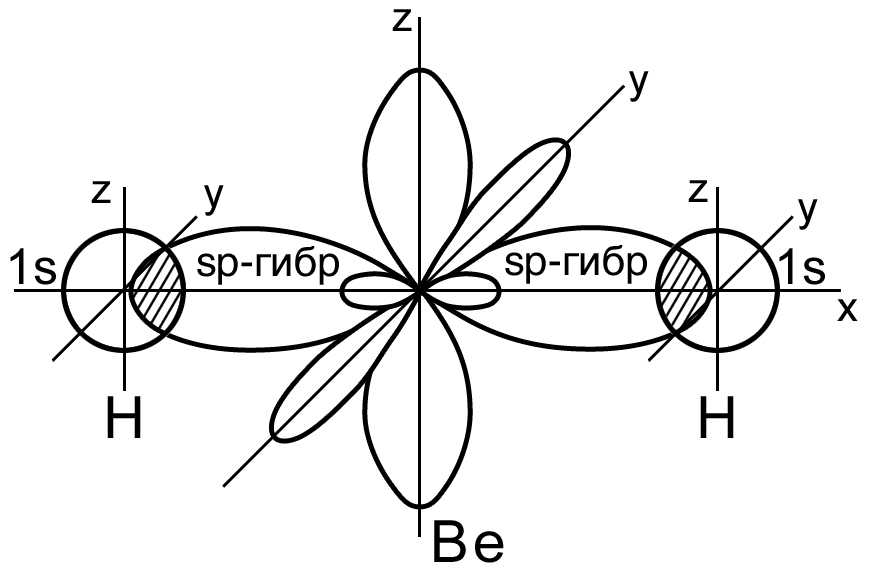
Рис. 13. Пространственная конфигурация молекулы BeH2
Пример 2. Перекрывание sp2 – гибридных орбиталей атома бора с 1s – АО трех атомов водорода приводит к образованию треугольной (тригональной) молекулы гидрида бора BH3; валентный угол H – B – H в молекуле BH3 равен 120о (рис. 14).
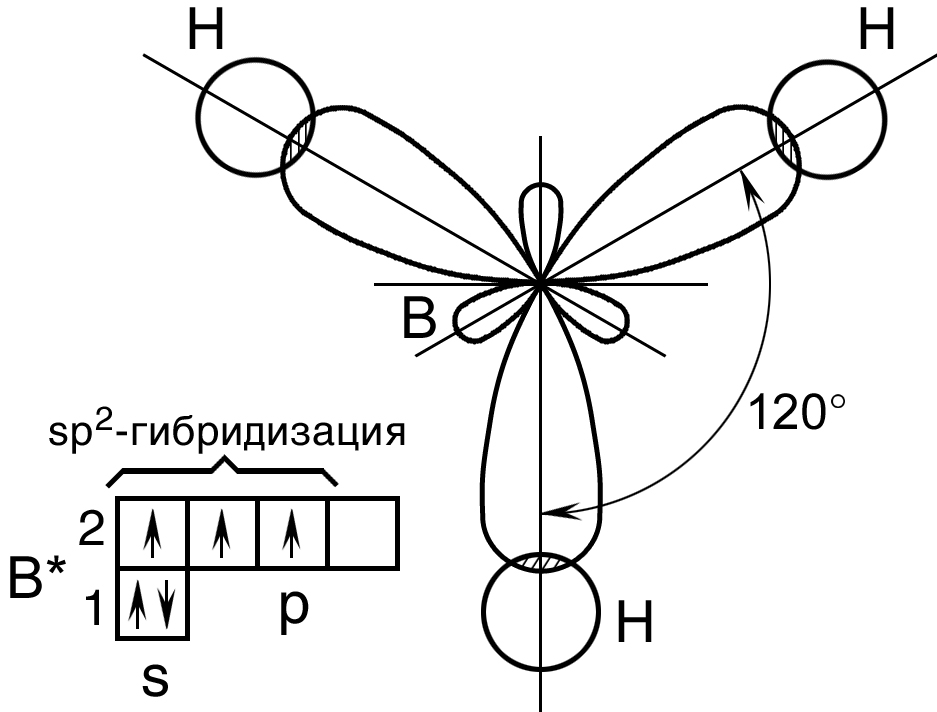
Рис. 14. Пространственная конфигурация молекулы BH3
Пример 3. Перекрывание sp3 – гибридных орбиталей атома кремния с 1s – АО четырех атомов водорода приводит к образованию тетраэдрической молекулы силана SiH4; валентный угол H-Si-H равен 109,5о (рис. 15).
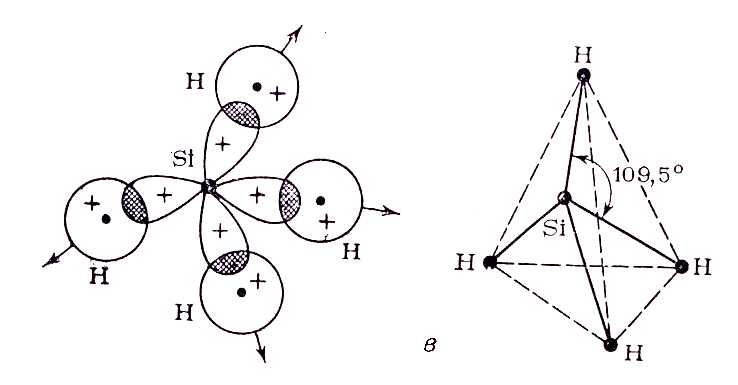
Рис. 15. Пространственная конфигурация молекулы SiH4
Разные по составу молекулы СН4, NH3 и H2O имеют одинаковое пространственное расположение связей. Этот факт подтверждает гибридизацию орбиталей. Атомы углерода, азота и кислорода в указанных молекулах находятся в состоянии sp3 - гибридизации.
Молекула аммиака. В невозбужденном состоянии центральный атом азота в молекуле аммиака NH3 имеет 1s2 2s2 2p3 - электронную конфигурацию.
Графическая схема распределения электронов по энергетическим ячейкам представлена схемой на рис. 16, согласно которой могут образоваться три взаимно перпендикулярные связи с тремя атомами водорода. Однако в действительности валентные углы в аммиаке равны 107о при тетраэдрическом их расположении. Азот в молекуле аммиака находится в sp3–гибридном состоянии. При этом гибридизуются 2s – орбиталь, заполненная парой электронов и три 2p – орбитали, имеющие по одному электрону. В результате получается четыре sp3 – гибридных орбитали, из которых одна содержит неподеленную пару электронов. Остальные три гидридные орбитали перекрываются с орбиталями трех атомов водорода. Неподеленная пара электронов находится в одной из вершин тетраэдра, а атомы водорода расположены в вершинах основания тетраэдра, т.е. находятся в одной плоскости (рис. 16).
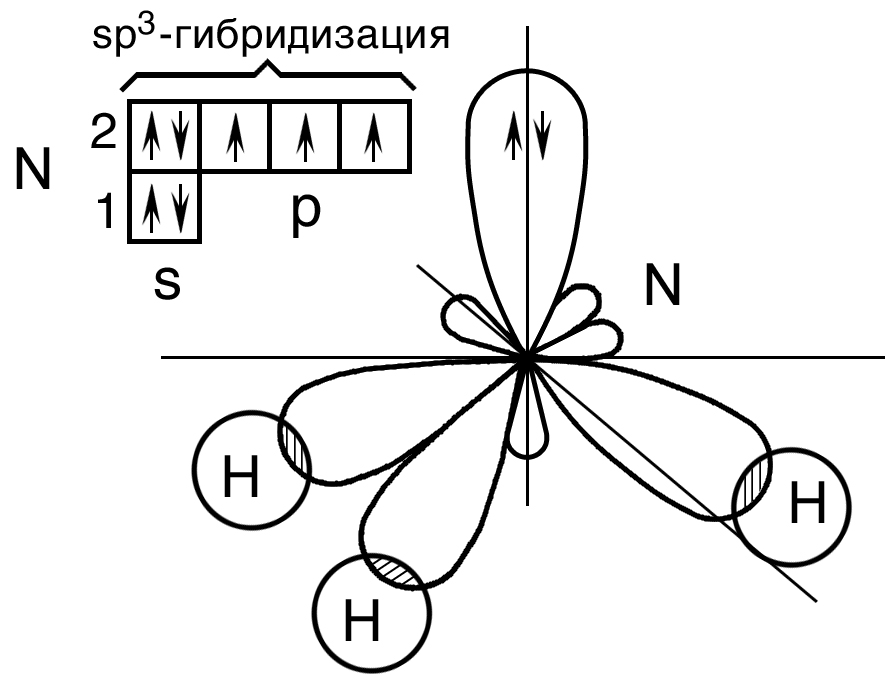
Рис. 16. Пространственная конфигурация молекулы NH3
Молекула воды. В молекуле воды H2O центральным атомом является атом кислорода, который в невозбужденном состоянии имеет следующую электронную конфигурацию: 1s22s22p2.
Кислород в молекуле воды также находится в состоянии sp3 – гибридизации (рис. 17).
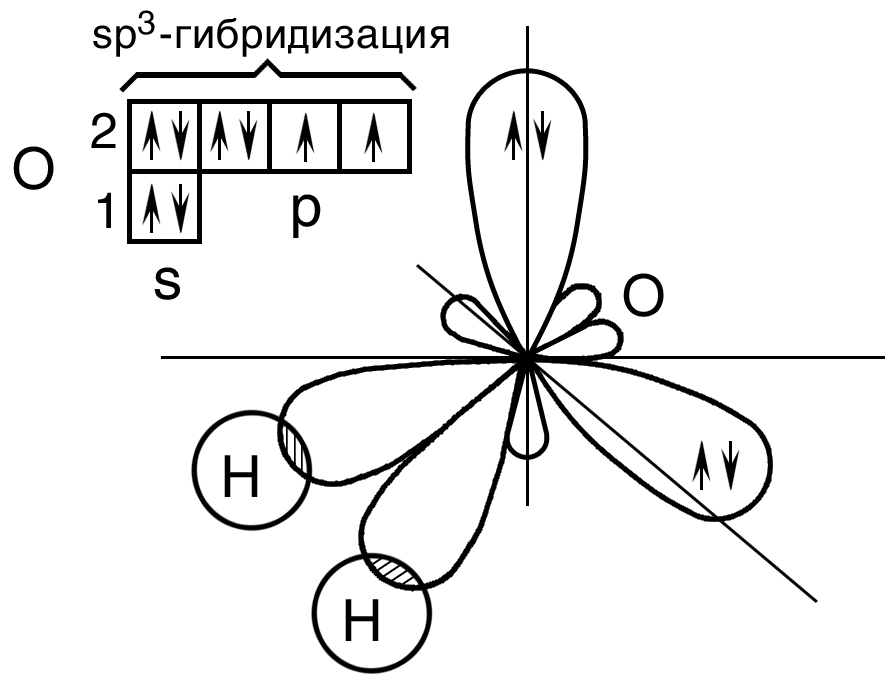
Рис. 17. Пространственная конфигурация молекулы Н2О

Рис. 18. Тетраэдрическое расположение связей в молекуле воды
В отличие от молекулы аммиака, в молекуле воды имеются две гибридные орбитали с неподеленными парами электронов и две гибридные орбитали, имеющие по одному электрону. Валентный угол между связями равен 104,5о при тетраэдрическом их расположении (рис. 18).
У рассмотренных молекул аммиака и воды углы между связями отклоняются от тетраэдрического 109о29′ и прямого 90о. Это обусловлено различием сил взаимного отталкивания орбиталей, заполненных только парой электронов, и орбиталей, перекрывающихся с атомами водорода. Орбитали с парой электронов, т.е. не имеющие области перекрывания, обладают бόльшим отталкивающим эффектов по сравнению с орбиталями, образующими связь.
В молекуле NH3 имеется одна sp3 – гибридная орбиталь, заполненная парой электронов, и она отталкивает в направлении от себя три остальные орбитали связи N - H, уменьшая угол до 107о. В молекуле H2O - две орбитали с парами электронов. Их влияние на орбитали связи еще сильнее, и угол H-O-H уменьшается до 104,5о.
