
- •2. Спектроскопические и другие оптические методы анализа
- •2.1. Основные характеристики электромагнитного излучения
- •2.2. Принципы аналитической оптической спектроскопии
- •2.3. Параметры спектральной полосы и использование спектров для химического анализа
- •2.4. Приборы для оптического спектрального анализа
- •2.4.1.Спектральные приборы и их основные характеристики
- •2.4.2. Приемники излучения
- •2.5. Атомно-эмиссионная спектроскопия
- •Виды атомизаторов
- •2.6. Атомно-адсорбционный спектральный анализ
- •2.7. Фотометрия растворов
- •Основные методы определения концентрации
- •Растворы сравнения (нулевые)
- •Отклонения от основного закона светопоглощения
- •Фотоколориметрическое титрование
- •2.8. Метод инфракрасной спектроскопии
- •2.9. Люминесцентный анализ
- •2.10. Рефрактометрический анализ
- •2.11. Поляриметрический метод анализа
- •2.12. Нефелометрия и турбидиметрия
2. Спектроскопические и другие оптические методы анализа
2.1. Основные характеристики электромагнитного излучения
Спектроскопические методы анализа основаны на способности атомов и молекул вещества испускать, поглощать или рассеивать электромагнитное излучение. Регистрируя испускание, поглощение или рассеяние электромагнитных волн анализируемой системой, получают совокупность сигналов, характеризующих ее качественный и количественный состав. Спектроскопические методы позволяют получать и исследовать сигналы в различных областях спектра электромагнитных волн. В зависимости от длины волны в электромагнитном спектре выделяют следующие участки:
Интервал длин волн, м |
Участок спектра |
10-13–10-10 |
γ-излучение |
10-11–10-8 |
Рентгеновское излучение |
10-8– 4∙10-7 |
Ультрафиолетовое излучение |
4∙10-7– 7,6 ∙10-7 |
Видимый свет |
7,6 ∙10-7–10-3 |
Инфракрасное излучение |
10-3–1 |
Микроволны |
λ–1 |
Радиоволны |
Для целей химического анализа наибольшее значение имеют спектральные методы, оперирующие с излучением оптического диапазона шкалы электромагнитных волн (область от λ от 10-7 до 10-4 м). Электромагнитное излучение или свет имеет двойственную природу – волновую и корпускулярную, поэтому для его описания используют два вида характеристик – волновые и квантовые. К волновым характеристикам относятся частота колебаний, длина волны и волновое число, к квантовым – энергия квантов.
Частота колебаний ν показывает число колебаний в 1 с, измеряется в герцах (Гц).
Длина волны λ показывает наименьшее расстояние между точками, колеблющимися в одинаковых фазах; измеряется в метрах (м).
Длина
волны и частота связаны между собой
соотношением
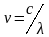 ,
где с-скорость света. Для вакуума
с=2,9979∙108
м∙с-1.
,
где с-скорость света. Для вакуума
с=2,9979∙108
м∙с-1.
Величину,
обратную длине волны, называют волновым
числом ν’
и
выражают обычно в см-1:
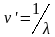 .
.
Связь
между волновой и корпускулярной природой
света описывается уравнением Планка:
![]() ;
где ∆Е – изменение энергии электромагнитной
системы в результате поглощения или
испускания фотона с энергией hν
(h=6.6262
∙10-34
Дж∙с
–
постоянная Планка).
;
где ∆Е – изменение энергии электромагнитной
системы в результате поглощения или
испускания фотона с энергией hν
(h=6.6262
∙10-34
Дж∙с
–
постоянная Планка).
2.2. Принципы аналитической оптической спектроскопии
В соответствии с квантовой теорией каждая частица вещества (атом, молекула) может находиться только в определенных стационарных состояниях. Таким состояниям соответствует дискретная последовательность энергии (энергетических уровней или термов). Состояние с минимальной энергией называют основным, а все остальные – возбужденными. Переход частицы из одного стационарного состояния в другое сопровождается испусканием или поглощением кванта электромагнитного излучения – фотона. Осуществляются однако, не все переходы. Часть их запрещена так называемыми правилами отбора. На рис. 2.1. а изображена схема переходов между различными состояниями частицы.
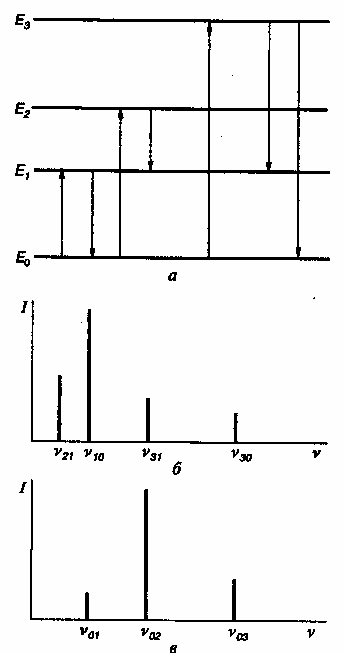
Рис. 2.1. Переходы между энергетическими уровнями частицы (а) и спектры ее испускания (б) и поглощения (в).
Горизонтальные линии соответствуют уровням энергии различных состояний: Ео – уровень энергии основного состояния; Е1, Е2, Е3 – уровни возбужденных состояний в порядке возрастания их энергии. Стрелки, направленные вниз, соответствуют испусканию, а стрелки, направленные вверх – поглощению фотона.
Каждому
переходу отвечает монохроматическая
спектральная линия определенной частоты
(или длины волны) и интенсивности (I)
(рис.2.1.б, в). Частота и длина спектральной
линии определяются выражением
Еi-Ej=hνij=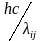 ,
где Ei
и Ej
– энергии исходного и конечного состояний
частицы, соответственно; νij
(λ
ij)
– частота (длина волны) этого перехода.
,
где Ei
и Ej
– энергии исходного и конечного состояний
частицы, соответственно; νij
(λ
ij)
– частота (длина волны) этого перехода.
Интенсивность спектральной линии I(νij) определяется количеством лучистой энергии с частотой νij, испускаемой или поглощаемой частицей в единицу времени.
Совокупность спектральных линий, принадлежащих данной частице, составляет ее спектр – важнейшую характеристику электромагнитного излучения.
Спектр – (от лат. spectrum – представление) – совокупность различных значений, которые может принимать данная физическая величина. Спектр может быть непрерывным и дискретным.
Если спектр обусловлен переходами при которых Ei>Ej, то его называют спектром испускания (рис.2.1.б). Спектры, испускаемые термически возбужденными частицами, называют эмиссионными. Спектры испускания нетермически возбужденных частиц (например, квантами электромагнитного излучения, потоком электронов и т.д.) принято называть спектрами люминесценции. Спектр поглощения, или абсорбционный спектр, возникает в случае переходов, у которых Ei<Ej (рис.2.1.в). Линии, возникающие в результате переходов в основное или из основного состояния, и соответствующие переходы называют резонансными.
В зависимости от расстояния между уровнями Ei и Ej спектральная линия может попасть в любую область шкалы электромагнитных волн. Спектры, расположенные в оптическом диапазоне шкалы электромагнитных волн, называют оптическими. Оптический диапазон обычно подразделяют на ультрафиолетовую (УФ), видимую и инфракрасную (ИК) спектральные области. (В ультрафиолетовой и видимой областях чаще используют длину волны как единицу измерения, а в инфракрасной области - частоту).
Спектры атомов в УФ, видимой и ближней ИК областях возникают при переходах внешних валентных электронов из одних энергетических состояний в другие. Спектры атомов состоят из большого числа дискретных спектральных линий, объединяемых в отдельные спектральные серии. Исследуя атомные спектры образца, можно установить наличие в нем тех или иных химических элементов.
Исследуя атомные спектры образца, можно установить наличие в нем тех или иных химических элементов.
Спектры молекул значительно сложнее спектров атомов, поскольку они обусловлены не только электронными переходами, но и колебаниями атомных ядер в молекуле, а так же вращательным движением самой молекулы как целого. Приближенно энергию молекулы можно представить в виде суммы электронной Еэл., колебательной Екол., и вращательной Евр. энергии:
Е = Еэл + Екол + Евр.
По порядку величин эти виды энергии существенно различаются:
Еэл>>Екол>>Евр.
При изменении вращательной энергии молекулы возникает линейчатый вращательный спектр, наблюдаемый в микроволновой и дальней ИК областях спектра (0,03-30 см-1).
Изменение колебательной энергии молекулы обычно сопровождается изменением ее вращательной энергии. В результате вместо чисто колебательных переходов у молекулы наблюдаются колебательно-вращательные переходы. Соответствующий спектр состоит из большого числа близко расположенных друг к другу линий, которые группируются в отдельные полосы, наблюдаемые в средней и дальней ИК–области (30–4∙103 см–1).
При изменении энергии электронов у молекулы одновременно изменяются колебательная и вращательная энергии и вместо электронных наблюдаются электронно-колебательно-вращательные переходы. Поскольку их число очень велико, то электронно-колебательно-вращательный спектр, обычно называемый электронным, принимает вид широких перекрывающихся полос в УФ, видимой и ближней ИК областях. Молекулярные спектры очень специфичны и широко используются для идентификации веществ и исследовании их структуры.
