- •Сірковмісні сполуки
- •Тіоли (тіоспирти, меркаптани) та сульфіди
- •13.1.1 Будова та властивості тіолів.
- •13.1.2 Хімічні властивості тіолів
- •Сульфонові кислоти та їх похідні
- •Будова та властивості сульфонових кислот
- •13.2.3 Хімічні властивості сульфокислот
- •13.2.4 Методи добування сульфокислот
- •В алентні стани азоту
- •12.1.3 Хімічні властивості нітросполук
- •12.1.4 Методи добування нітросполук
- •12.2.1 Класифікація амінів
- •12.2.2 Номенклатура та ізомерія
- •Будова й властивості амінів
- •12.2.5 Методи добування амінів
- •Солі арендіазонію
- •12.3.1 Хімічні властивості
13.2.4 Методи добування сульфокислот
![]() 1.
Сульфування. Методи добування
алкансульфонових кислот і аренсульфонових
кислот дещо розрізняються. Пряме
сульфоокиснення алканів і циклоалканів
відбувається за радикальним механізмом.
При освітленні:
1.
Сульфування. Методи добування
алкансульфонових кислот і аренсульфонових
кислот дещо розрізняються. Пряме
сульфоокиснення алканів і циклоалканів
відбувається за радикальним механізмом.
При освітленні:
А![]() рени
сульфуються концентрованою сірчаною
кислотою або олеумом:
рени
сульфуються концентрованою сірчаною
кислотою або олеумом:
2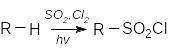 .
Сульфохлорування алканів.
.
Сульфохлорування алканів.
![]() Арени
сульфохлоруються надлишком хлорсульфонової
кислоти:
Арени
сульфохлоруються надлишком хлорсульфонової
кислоти:
Сульфохлориди, що утворюються, можна гідролізовати до сульфонових кислот
3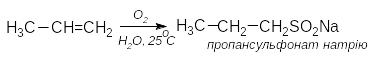 .
Взаємодія алкенів з гідросульфітом
натрію. Відбувається проти правила
Марковникова
.
Взаємодія алкенів з гідросульфітом
натрію. Відбувається проти правила
Марковникова
4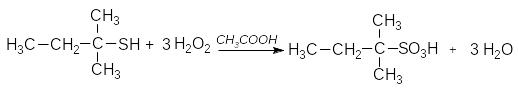 .
Окиснення тіолів.
.
Окиснення тіолів.
АЗОТОВМІСНІ СПОЛУКИ
Сполуки, що містять азот, займають особливе місце тому, що вони приймають участь у побудові біополімерів - білків та нуклеїнових кислот, без яких неможливе існування живої матерії.
В органічних сполуках азот може утворювати двохелектронні зв’язки, а також двохелектронні зв’язки з одночасним приєднанням або вилученням електрону:
В алентні стани азоту
НІТРОСПОЛУКИ
Це сполуки, що містять у своєму складі, одну або кілька нітрогруп - NO2
12.1.1 Класифікація нітросполук
Нітросполуки можна класифікувати залежно від гібридизації атома вуглецю, з яким сполучена нітрогрупа.
Н
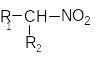
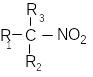 ітроалкани
Сsp3
NO2
в свою
чергу поділяють на первинні -RCH2NO2,
вторинні
- , третинні - .
ітроалкани
Сsp3
NO2
в свою
чергу поділяють на первинні -RCH2NO2,
вторинні
- , третинні - .
2. Нітроалкени й нітроарени Сsp2 NO2
12.1.2 Будова нітрогрупи
Нітрогрупа має планарну (тобто плоску) будову. Атоми азоту та кисню знаходяться в стані sp2-гібридизації. Нітрогрупу можна уявити як резонансні гібриди:

У нітрогрупі відбувається повне вирівнювання розподілу заряду між атомами кисню. було доведено, що довжина обох NO-зв’язків є однаковою - 0,12 нм, а кут між ними дорівнює 124-126о.
Нітрогрупа – сильна електроноакцепторні група, виявляє сильні І та М-ефекти
12.1.3 Хімічні властивості нітросполук
Взаємодія з лугами.
Унаслідок сильних електроноакцепторних властивостей нітрогрупа активує водневі атомі -вуглецевого атому. Тому первинні та вторинні нітроалкани є таутомерними сполуками
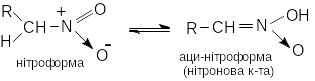
В нейтральному середовищі рівновага майже повністю зміщена в бік нітроформи. В лужному середовищі таутомерна рівновага зміщується в бік аци-нітроформи. Первинні та вторинні нітроалкани розчиняються у водних розчинах лугів з утворенням солей нітронових кислот. (ці солі вибухонебезпечні) Третинні не розчиняються.
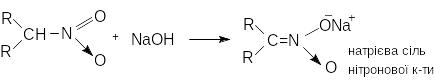
При обробці лужного розчину нітроалкану знов утворюється розчинна у воді нестійка нітронова кислота, яка перетворюється на нерозчинний у воді нітроалкан.
2. Взаємодія з мінеральними кислотами.
Концентровані розчини кислот (наприклад, 85% сірчана кислота) гідролізують нітроалкани до карбонових кислот і гідроксиламіну:

нітроетан гідроксамова кислота оцтова кислота сіль гідрокси
ламіну
Це промисловий метод добування гідроксиламіну.
3. Взаємодія з нітритною (азотистою) кислотою. – якісна реакція
Первинні нітроалкани перетворюються на нітролові кислоти, які при нейтралізації утворюють солі червоного кольору:
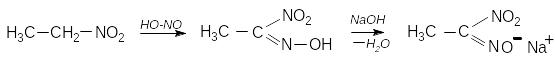
етилнітролова к-та
Вторинні нітроалкани за цих умов перетворюються на безбарвні нітрозонітросполуки, які в розчині мають інтенсивне бірюзове забарвлення, що використовують при колориметричному визначенні вторинних нітросполук:
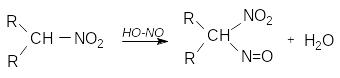
Третинні нітроалкани з нітритною кислотою не реагують.
4. Реакціі по ароматичному радикалу.
Нітрогрупа є одним з найсильніших електрофільних замісників. Якщо вона сполучена з бензеновим ядром, то внаслідок її М-ефекту відбувається зменшення електронної густини бензенового ядра, особливо в орто- й пара-положеннях. Через це реакції електрофільного заміщення (нітрування, сульфування та галогенування) відбуваються в жорсткіших умовах порівняно з бензеном і переважно в мета-положення.
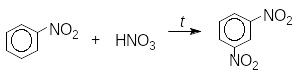
Введення третьої нітрогрупи ще важче здійснити.
Реакція Фріделя-Крафтса не йде, тому нітробензен часто використовують як розчинник для цієї реакції.
У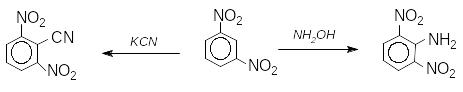 той же час нітроарени здатні до реакцій
нуклеофільного заміщення по бензеновому
ядру в орто-
та
пара-положеннях:
той же час нітроарени здатні до реакцій
нуклеофільного заміщення по бензеновому
ядру в орто-
та
пара-положеннях:
2,6-динітробензонітрил 2,6-динітроанілін
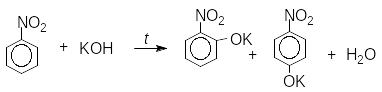
Нітрогрупа зменшує електронну густину бензенового ядра й, водночас, збільшує рухливість замісників в орто- та пара-положеннях:
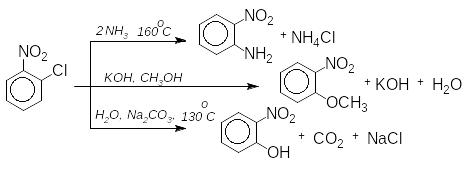
Накопичування нітрогруп в бензеновому ядрі швидко збільшує здатність до реакцій нуклеофільного заміщення. В молекулі пікрилхлориду заміщення галогену на метокси-групу відбувається при кімнатній температурі:

5. Реакції відновлення
При відновленні нітроалканів хлоридом олова або заліза в присутності хлороводневої кислоти утворюються первинні аміни:
C2H5NO2 + 6H C2H5NH2 + H2O
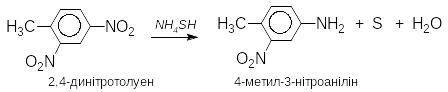
При відновленні нітроаренів утворюються ароматичні аміни (реакція Зиніна ) Як відновники використовують залізо, олово або цинк в хлороводневій кислоті, сульфід амонію, гідросульфід амонію. Залежно від рН реакційного середовища процес відновлення може йти за двома напрямками, які відрізняються утворенням різних проміжних сполук.
В нейтральному та кислому середовищі:
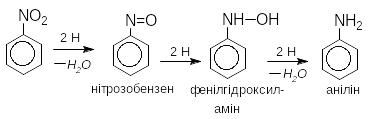
В лужному середовищі відбувається конденсація нітрозосполук з арилгідроксиламіном з утворенням азосполук.
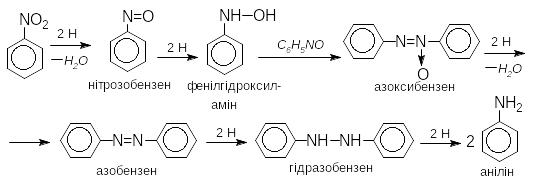
Реакцію відновлення нітроаренів в нейтральному або лужному середовищі можна зупинити на будь-якій стадії
У випадку динітросполук у м΄яких умовах (гідросульфідом амонію) можливе відновлення тільки однієї нітрогрупи: