
- •Сірковмісні сполуки
- •Тіоли (тіоспирти, меркаптани) та сульфіди
- •13.1.1 Будова та властивості тіолів.
- •13.1.2 Хімічні властивості тіолів
- •Сульфонові кислоти та їх похідні
- •Будова та властивості сульфонових кислот
- •13.2.3 Хімічні властивості сульфокислот
- •13.2.4 Методи добування сульфокислот
- •В алентні стани азоту
- •12.1.3 Хімічні властивості нітросполук
- •12.1.4 Методи добування нітросполук
- •12.2.1 Класифікація амінів
- •12.2.2 Номенклатура та ізомерія
- •Будова й властивості амінів
- •12.2.5 Методи добування амінів
- •Солі арендіазонію
- •12.3.1 Хімічні властивості
Сульфонові кислоти та їх похідні
Сульфонові кислоти містять у складі молекули сульфогрупу SO3H. Сполуки цього класу використовують у виробництві поверхнево-активних речовин (ПАР), штучних барвників та лікувальних засобів, тому вони мають дуже велике значення.
Будова та властивості сульфонових кислот
С ульфокислоти,
подібно сірчаної кислоті, є сильними
кислотами, у водному розчині вони
повністю дисоціюють: ArSO3H
+ H2O
H3O+
+ ArSO3.
Атом сірки сполучений з двома кисневими
атомами та гідроксильною групою.
Електронна густина зміщена до кисневих
атомів, що спричинює додаткову поляризацію
зв’язку О
Н і зумовлює кислотні властивості
сульфонової групи. Проте сульфокислоти
слабкіші за сірчану кислоту.
ульфокислоти,
подібно сірчаної кислоті, є сильними
кислотами, у водному розчині вони
повністю дисоціюють: ArSO3H
+ H2O
H3O+
+ ArSO3.
Атом сірки сполучений з двома кисневими
атомами та гідроксильною групою.
Електронна густина зміщена до кисневих
атомів, що спричинює додаткову поляризацію
зв’язку О
Н і зумовлює кислотні властивості
сульфонової групи. Проте сульфокислоти
слабкіші за сірчану кислоту.
![]() Б
Б уло
з’ясовано, що подвійних зв’язків у
сульфогрупі взагалі немає, а негативний
заряд сульфаніону розподілено між
трьома кисневими атомами, тобто вони
рівноцінні. Зв’язок S=О є семиполярним
й утворюється за рахунок неподілених
електронних пар атома сірки, який набуває
при цьому позитивного заряду, а атом
кисню - негативний заряд. Тому сульфогрупа
не виявляє мезомерного ефекту (М=0),
а виявляє тільки І-ефект.
уло
з’ясовано, що подвійних зв’язків у
сульфогрупі взагалі немає, а негативний
заряд сульфаніону розподілено між
трьома кисневими атомами, тобто вони
рівноцінні. Зв’язок S=О є семиполярним
й утворюється за рахунок неподілених
електронних пар атома сірки, який набуває
при цьому позитивного заряду, а атом
кисню - негативний заряд. Тому сульфогрупа
не виявляє мезомерного ефекту (М=0),
а виявляє тільки І-ефект.
13.2.3 Хімічні властивості сульфокислот
1. Утворення солей. (сульфонатів)

Натрієві солі алкансульфонових кислот (12-18 вуглецевих атомів) використовують в сучасних миючих засобах, що замінюють мило, зберігають добрі миючи властивості в жорсткій воді, навіть в морській. Для цих же цілей використовують алкілбензенсульфонові кислоти (ЛАБС)
2. Утворення похідних сульфокислот.
Наявність двох кисневих атомів у сульфогрупі хоча й сприяє іонізації водневого атома, але й водночас утруднює заміщення гідроксильної групи. Тому з усіх похідних сульфокислот тільки хлорангідриди отримують безпосередньо із сульфокислот.
а) Утворення сульфонілхлоридів (сульфохлоридів).


п-толуенсульфохлорид
Хлорангідриди сульфонових кислот надзвичайно реакційноздатні сполуки, тому їх використовують для синтезу інших похідних сульфонових кислот. Сульфохлориди гідролізуються водою до сульфонових кислот і відновлюються до тіолів.
б) Утворення сульфоестерів
Сульфохлориди взаємодіють із спиртами в присутності гідроксиду натрію або піридину з утворенням алкілсульфонатів - сульфоестерів:
![]()
Сульфоестери використовують як алкілюючі агенти.
в) Утворення сульфонамідів (сульфамідів).
Сульфаміди утворюються при взаємодії сульфохлоридів з амоніаком або з первинними й вторинними амінами:
![]()

N-метилбензенсульфамід
При взаємодії сульфамідів з гіпохлоритом утворюються N-хлорасульфаміди - поширені засоби для дезинфекції – сильніші антисептики.

дихлорамін Б хлорамін Б
Багато похідних сульфамідів знайшли використання в медицині, як ефективні ліки. Близько 40 похідних аміду сульфанілової кислоти це препарати антимікробної дії широкого спектру - сульфаніламіди.
О-Толуенсульфамід використовують для синтезу сахарину – речовини, що в 550 разів солодша за цукор:

3. Реакції нуклеофільного заміщення сульфогрупи (лужне стоплення)
Натрієві солі ароматичних сульфокислот при нагріванні з нуклеофільними реагентами (200-300оС) перетворюються на різноманітні сполуки. Це знайшло широке застосування в органічному синтезі:
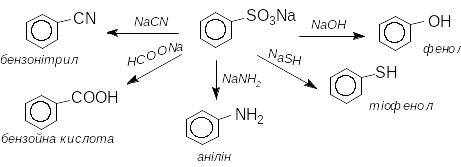
4. Електрофільне заміщення сульфогрупи.
При нагріванні ароматичних сульфонових кислот з розведеною соляною кислотою або обробкою перегрітою парою вони гідролізуються (сульфогрупа “змивається”):

Деякі сульфокислоти десульфуються навіть при перегонці з водяною парою
5. Реакції по бензеновому ядру.
Сульфогрупа виявляє сильний І-ефект, пасивує ароматичне ядро до SE-реакцій та орієнтує наступне заміщення в мета-положення (орієнтант ІІ роду):

