
- •8. Оксосполуки (Альдегіди й кетони)
- •8.1 Класифікація карбонільних сполук
- •Бензохінон-1,4 нафтохінон-1,4
- •8. 2 Номенклатура та ізомерія
- •8.3 Будова та властивості оксосполук
- •8.3.1 Фізичні властивості
- •8.3.2 Хімічні властивості оксосполук
- •8.3.2.1 Нуклеофільне приєднання
- •Ціангідринний синтез
- •Приєднання гідросульфіту натрію
- •Реакція гідратації
- •Приєднання спиртів
- •Приєднання магнійорганічних сполук (реактивів Ґриняра)
- •Приєднання аміаку та його похідних
- •Відновлення карбонільних сполук
- •8.3.2.2 Реакції окиснення
- •8.3.2.3 Реакція Канніццаро
- •8.3.2.4 Реакціі карбонільних сполук по радикалу
- •8.3.2.5 Реакції заміщення карбонильного кисню
- •8.3.2.6 Галоформна реакція на метилкетони
- •8.3.2.7 Реакції полімеризації
- •8.4 Методи добування карбонільних сполук
- •8.5. Окремі представники карбонільних сполук
8. Оксосполуки (Альдегіди й кетони)
Ц![]() е
клас органічних сполук, що містять
карбонільну групу (або оксогрупу)
.
е
клас органічних сполук, що містять
карбонільну групу (або оксогрупу)
.
8.1 Класифікація карбонільних сполук
З а
будовою вуглецевих радикалів:
а
будовою вуглецевих радикалів:
1. Насичені:
пропанон-2 пропаналь
2 .
Ненасичені:
.
Ненасичені:
пропен-2-аль пентен-4-он-2
3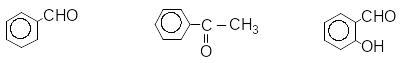 .
Ароматичні й комбіновані:
.
Ароматичні й комбіновані:
бензальдегід ацетофенон саліциловий ангідрид
З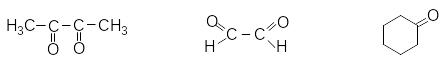 а
кількістю карбонільних груп:
а
кількістю карбонільних груп:
бутандіон-2,3 етандіаль циклогексанон
Ц иклічні
кетони з кон’юґованими подвійними
зв’язками отримали назву хінонів:
иклічні
кетони з кон’юґованими подвійними
зв’язками отримали назву хінонів:
Бензохінон-1,4 нафтохінон-1,4
8. 2 Номенклатура та ізомерія
![]() Молекули
альдегідів мають загальну формулу
, назву сполуки утворюють
додаванням суфіксу -аль
до назви відповідного алкану. Нумерацію
вуглецевого ланцюга починають з
вуглецевого атома карбонільної групи.
У випадку циклічних або ароматичних
сполук нумерацію починають з вуглецю,
що сполучений з карбонільною групою, і
додають до назви сполуки закінчення –
карбальдегід.
Молекули
альдегідів мають загальну формулу
, назву сполуки утворюють
додаванням суфіксу -аль
до назви відповідного алкану. Нумерацію
вуглецевого ланцюга починають з
вуглецевого атома карбонільної групи.
У випадку циклічних або ароматичних
сполук нумерацію починають з вуглецю,
що сполучений з карбонільною групою, і
додають до назви сполуки закінчення –
карбальдегід.
Якщо карбонільний вуглецевий атом сполучений тільки з арильними або алкільними групами, то така сполука є кетоном і назву її утворюють додаванням до назви відповідного алкану суфікса –он.
І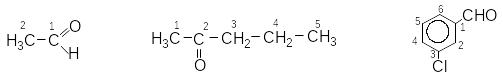 сторична
номенклатура альдегідів часто використовує
тривіальні назви відповідних карбонових
кислот, замінюючи в назві слово “кислота”
на слово “альдегід”. Наприклад, мурашиний
альдегід, оцтовий альдегід, масляний
альдегід та інші. А назви кетонів
утворюють, додаючи назви радикалів до
закінчення –кетон.
сторична
номенклатура альдегідів часто використовує
тривіальні назви відповідних карбонових
кислот, замінюючи в назві слово “кислота”
на слово “альдегід”. Наприклад, мурашиний
альдегід, оцтовий альдегід, масляний
альдегід та інші. А назви кетонів
утворюють, додаючи назви радикалів до
закінчення –кетон.
етаналь пентанон-2 3-хлорбензенкарбальдегід
о цтовий
альдегід метилпропілкетон
м-хлорбензальдегід
цтовий
альдегід метилпропілкетон
м-хлорбензальдегід
формальдегід метилфенілкетон дифенілкетон
мурашиний альдегід ацетофенон бензофенон
Також часто вживають тривіальні назви, наприклад, пропанон частіше називають ацетоном.
Ізомерія карбонільних сполук визначається будовою вуглецевого радикалу й розміщенням карбонільної групи (для кетонів). Альдегідам і кетонам притаманні всі види ізомерії, що пов’язані з розгалуженням вуглецевого радикалу: структурна, геометрична, оптична.
8.3 Будова та властивості оксосполук

А![]() том
вуглецю карбонільної групи знаходиться
у стані sp2-гібридизації,
-зв’язки
розміщені під кутом 120о
відносно один одного, р-орбіталь, що
залишилася, перекриваючись з р-орбіталлю
атома кисню, утворює -зв’язок.
Таким чином, між киснем і вуглецем
виникає подвійний зв’язок. Він сильно
скорочений, має довжину 0,120 нм й енергію
750 кДж. Атом вуглецю менш електронегативний
ніж кисень, тому електрони -зв’язку
зміщені до більш електронегативного
атома кисню, унаслідок чого на ньому
утворюється частковий негативний заряд,
а на вуглецевому атомі - частковий
позитивний. Реакційна
здатність карбонільних сполук визначається
величиною часткового позитивного заряду
на вуглецевому атомі карбонільної
групи.
том
вуглецю карбонільної групи знаходиться
у стані sp2-гібридизації,
-зв’язки
розміщені під кутом 120о
відносно один одного, р-орбіталь, що
залишилася, перекриваючись з р-орбіталлю
атома кисню, утворює -зв’язок.
Таким чином, між киснем і вуглецем
виникає подвійний зв’язок. Він сильно
скорочений, має довжину 0,120 нм й енергію
750 кДж. Атом вуглецю менш електронегативний
ніж кисень, тому електрони -зв’язку
зміщені до більш електронегативного
атома кисню, унаслідок чого на ньому
утворюється частковий негативний заряд,
а на вуглецевому атомі - частковий
позитивний. Реакційна
здатність карбонільних сполук визначається
величиною часткового позитивного заряду
на вуглецевому атомі карбонільної
групи.
![]()
![]() Карбонільна
група є електрофільним замісником,
виявляє негативні індуктивний та
мезомерний ефекти (І,
М):
; .
Карбонільна
група є електрофільним замісником,
виявляє негативні індуктивний та
мезомерний ефекти (І,
М):
; .
У кетонів ці ефекти менші, ніж у альдегідів, через те, що вони в деякій мірі компенсуються +І-ефектом алкільного радикалу.
З а
рахунок –М-ефекту
карбонільна група дезактивує орто-
і пара-положення
бензенового ядра до реакцій електрофільного
заміщення (SE).
а
рахунок –М-ефекту
карбонільна група дезактивує орто-
і пара-положення
бензенового ядра до реакцій електрофільного
заміщення (SE).
М айже
всі хімічні властивості альдегідів і
кетонів зумовлені атакою нуклеофільних
частинок -зв’язку
карбонільної групи С=О:
айже
всі хімічні властивості альдегідів і
кетонів зумовлені атакою нуклеофільних
частинок -зв’язку
карбонільної групи С=О:
Карбонільна група плоска, всі зв’язки sp2-гібридизованого вуглецевого атому розташовані в одній площині, а нуклеофільна атака здійснюється з обох боків цієї площини. Альдегідний атом водню також розташований в площині і здатен легко окиснюватися.. Неподілені електронні пари атома кисню взаємодіють з -електронами подвійного зв’язку, тому, на відміну від спиртів, їх здатність до протонування зменшена.
Окрім того, завдяки впливу І та М-ефектів карбонільної групи зменшується електронна густина на сусідньому, сполученому з нею -вуглецевому атомі. Через те -водневі атоми набувають підвищеної рухливості. Також це підвищення активності пов’язане із взаємодією -орбіталей -СН-зв’язків з -орбіталями подвійного зв’язку (, р-спряження або гіперкон’юґація).

Через те альдегіди й кетони можна вважати СН-кислотами. Завдяки підвищеній рухливості -водневих атомів альдегіди й кетони здатні до протонізації, реакцій конденсації та гомолітичного заміщення.
О кремим
випадком таутомерії є процес енолізації
– переходу від кетоформи до енольної,
який є властивим для карбонільних
сполук. Простіші альдегіди й кетони
існують переважно в кето-формі, тобто
як карбонільні сполуки. Наприклад,
ацетон і циклопропанон містять менше
1% енольної форми. Проте ацетилацетон
(2,4-пентадіон) приблизно на 80% існує в
енольній формі (енольну форму стабілізує
водневий зв’язок):
кремим
випадком таутомерії є процес енолізації
– переходу від кетоформи до енольної,
який є властивим для карбонільних
сполук. Простіші альдегіди й кетони
існують переважно в кето-формі, тобто
як карбонільні сполуки. Наприклад,
ацетон і циклопропанон містять менше
1% енольної форми. Проте ацетилацетон
(2,4-пентадіон) приблизно на 80% існує в
енольній формі (енольну форму стабілізує
водневий зв’язок):
Я кщо
енолізація каталізується кислотами,
лімітуючою стадією реакції є перетворення
протонованої кетоформи на енол:
кщо
енолізація каталізується кислотами,
лімітуючою стадією реакції є перетворення
протонованої кетоформи на енол:
Я кщо
енолізація каталізується основами,
лімітуючою стадією є перетворення
кетоформи на енолят-іон:
кщо
енолізація каталізується основами,
лімітуючою стадією є перетворення
кетоформи на енолят-іон:
