- •Порівняльна характеристика аренів
- •Будова ароматичних сполук
- •Будова молекули нафталену
- •Номенклатура і ізомерія
- •Хімічні властивості
- •Реакції електрофільного заміщення
- •Механізм електрофільного заміщення в бензеновому ядрі
- •Орієнтація заміщення в нафталеновому ядрі
- •5.6.1.5 Орієнтація в дизаміщених бензену
- •Реакції заміщення в бічному ланцюгу
Номенклатура і ізомерія
Б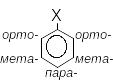 ензен
- це перший член гомологічного ряду
ароматичних вуглеводнів. Ароматичні
вуглеводні називають за систематичною
номенклатурою як заміщені бензену. Для
заміщених бензену нумерацію починають
від “найстаршого” замісника. За
пріоритетністю замісники розміщуються
в ряд:
ензен
- це перший член гомологічного ряду
ароматичних вуглеводнів. Ароматичні
вуглеводні називають за систематичною
номенклатурою як заміщені бензену. Для
заміщених бензену нумерацію починають
від “найстаршого” замісника. За
пріоритетністю замісники розміщуються
в ряд:
Інша система позначення замісників, яку теж визнає ІUPAC, заснована на використанні префіксів орто- (1,2-), мета- (1,3-) і пара- (1,4), які позначають вуглецеві атоми бензенового ядра відносно С-атома, який має приоритетний замісник. Префікси записують часто у скороченому вигляді – буквами: о-, м-і п-, наприклад:
п-нітроанілін о-амінофенол м-хлорбензенсульфонова к-та
Деякі історичні назви ароматичних вуглеводнів затверджено номенклатурою IUPAC, наприклад:

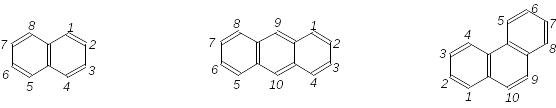
нафтален антрацен фенантрен
Радикали ароматичних вуглеводнів мають такі назви:

феніл орто-фенілен мета-фенілен пара-фенілен
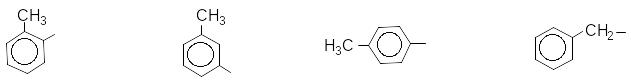
орто-толіл мета-толіл пара-толіл бензил
Ізомерія зумовлена розміщенням замісників, наприклад:
Ізомерія гомологів і похідних бензену зумовлена ізомерією радикалів (замісників), їх кількістю і положенням в бензеновому ядрі:
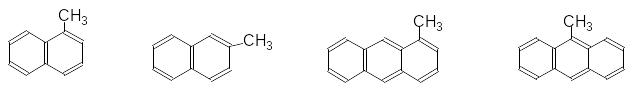

-метилнафтален -метилнафтален -метилантрацен -метилантрацен
:
Хімічні властивості
Бензен може вступати до реакцій заміщення, приєднання, фотохімічної ізомеризації, реакцій, що супроводжуються розривом бензольного кільця.
Реакції електрофільного заміщення
Для бензену та його похідних найбільш характерними є реакції електрофільного заміщення в ароматичному ядрі. Бензенове ядро є джерелом електронів, а сполуки, з якими воно реагує, є електронозбідненими електрофільними реагентами. Реакції електрофільного заміщення (SE) це нітрування (HNO3+H2SO4), галогенування (X2+AlCl3), сульфування (H2SO4), і реакції Фріделя-Крафтса (RX+AlCl3 -алкілювання, RCXO+ AlCl3 -ацилювання). Схему SE-реакції можна записати в загальному вигляді:

Механізм електрофільного заміщення в бензеновому ядрі
Електрофільне заміщення в бензеновому ядрі - це процес, що складається з кількох стадій. Спочатку при взаємодії реагенту з каталізатором утворюється електрофільна частинка, Потім відбувається поступове зближення електрофільної частинки з -електронною орбіталлю бензенового ядра. Дія частинки скерована перпендикулярно площині бензенового кільця. При цьому виникає донорно-акцепторний -комплекс:
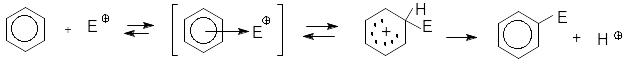
-комплекс -комплекс продукт реакції
Наступною стадією є атака одного з вуглецевих атомів електрофільною частинкою з утворенням -комплексу. Це невдала назва, хоч і закріпилася. Насправді утворюється карбокатіон, що має чотири неспарені -електрони і одну зв’язуючу ланку (+-заряд, який також делокалізований). -зв’язок охоплює 5 вуглецевих атомів Циклічної кон’юґаціїї немає, вона розірвана sp3-гібридизованим атомом. . Після цього відбувається вилучення протону й утворення продукту реакції.
ArH Hal2 ArHal HHal галогенування
У присутності каталізаторів (Fe3+, Al3+, Sb3+) галогени заміщують атом водню в бензеновому ядрі:
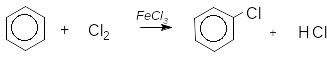
Електрофілом у цій реакції є катіон Cl+, який утворюється в процесі іонізації молекули хлору під дією каталізатора:
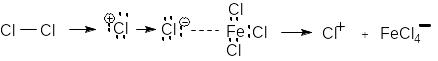
При хлоруванні нафталену в присутності FeCl3 і температурі 90-110оС утворюється переважно -хлорнафтален. Бромування відбуваються без каталізатора через стадію приєднання в положення 1,4 з наступним вилученням галогеноводню й утворенням монопохідного:
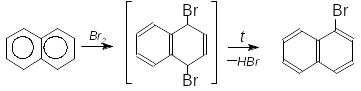
Антрацен (при 0ОС) і фенантрен теж спочатку приєднують галоген у положенні 9,10, а потім при нагріванні вилучають галогеноводень з утворенням 9-галогенпохідного.
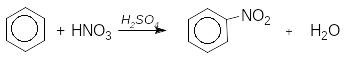
ArH HNO3 ArNO2 H2O нітрування
Бензен та його гомологи нітрують “нітруючою сумішшю” - сумішшю концентрованих азотної та сірчаної кислот:
Сірчана кислота збільшує швидкість реакції, тим, що протонує азотну кислоту, яка розкладається з утворенням нітроній-катіона:
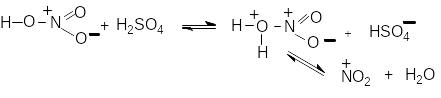
Н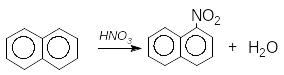 афтален
легко нітрується концентрованою азотною
кислотою або нітруючою сумішшю виключно
в -положення:
афтален
легко нітрується концентрованою азотною
кислотою або нітруючою сумішшю виключно
в -положення:
А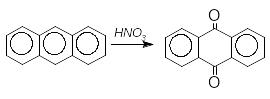 нтрацен
залежно від умов проведення реакції
нітрування може утворювати 9-нітроантрацен
або окиснюватися до антрахінону-9,10:
нтрацен
залежно від умов проведення реакції
нітрування може утворювати 9-нітроантрацен
або окиснюватися до антрахінону-9,10:
При нітруванні фенантрену азотною кислотою в середовищі оцтової кислот (20оС) утворюється 9-нітрофенантрен.
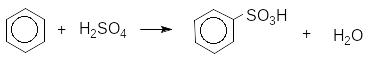
ArH H2SO4 ArSO3H H2O сульфування
Як реагенти сульфування використовують концентровану сірчану кислоту, олеум, оксид сірки (VI), хлористий сульфурил.
Електрофіл - катіон гідросульфонію - утворюється в концентрованій сірчаній кислоті за схемою:
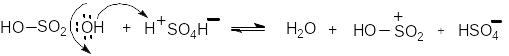
При дії концентрованої сірчаної кислоти нафтален сульфується, причому істотний вплив на напрямок реакції має температура реакційного середовища, Реакція оборотна
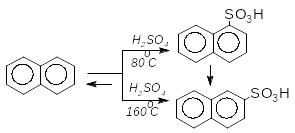
-нафталенсульфонова к-та
-нафталенсульфонова к-та
При високих температурах сульфування протягом тривалого часу утворюється така суміш ізомерів:
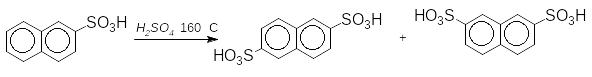
П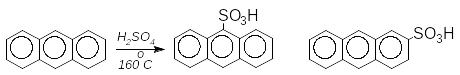 ри
сульфуванні антрацену утворюється
суміш:
ри
сульфуванні антрацену утворюється
суміш:
+
1-антраценсульфонова к-та 2-антраценсульфонова к-та
РЕАКЦІЇ ФРІДЕЛЯ-КРАФТСА
ArH RHal ArR HHal алкілювання
Це введення алкільної групи, найчастіше при дії галогеналканів в присутності хлориду алюмінію. Швидкість алкілювання залежить від природи галогену та алкільного радикалу.
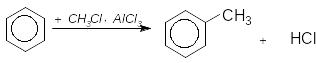
![]()
Реакції карбокатіонів (R+) часто ускладнюються перегрупуваннями, наприклад, при взаємодії бензену з н.пропілхлоридом та ізопропілхлоридом у присутності каталізатора як основний продукт реакції утворюється ізопропілбензен (кумен):
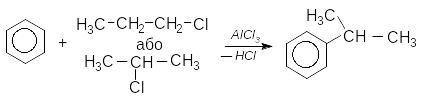
кумен
Алкілювати арени можна алкенами, спиртами, тобто сполуками, які легко утворюють карбокатіон у присутності каталізатора.
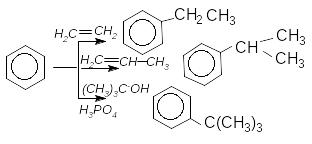
Алкілювання за Фріделем-Крафтсом має два недолікі. По-перше, перегрупування заважає отриманню алкілбензенів з нерозгалуженим ланцюгом без домішки ізомерів. По-друге, важко зупинити реакцію на стадії моноалкілювання.
ArH RCOHal ArCOR HHal ацилювання
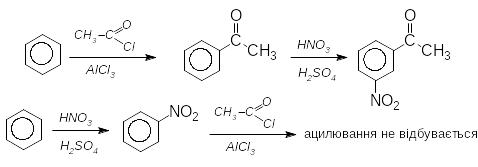
Це введення до складу молекули ацільної групи (залишку карбонової кислоти). Здійснюється галогенангідридами або ангідридами карбонових кислот в присутності хлориду алюмінію
З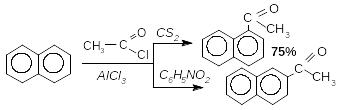 алежно
від природи розчинника ацилювання може
відбуватися в -
або -положення:
алежно
від природи розчинника ацилювання може
відбуватися в -
або -положення:
Здебільшого, як при алкілюванні нафталенів, утворюється суміш ізомерів
(Якщо молекула містить сильні електроноакцепторні замісники, здійснити ацилювання неможливо)
ArH HCHO + HCl ArCH2Cl H2O хлорметилювання
Р-ція використовується для отримання арілметилхлоридів, заснована на взаємодії аренів з формальдегідів та хлороводнем в присутності каталізаторів (AlCl3, ZnCl2)
ArH HCHO ArCH2OH оксиметилювання (з фенолами, амінами)
ArH ArN+N ArN=NAr азосполучення
Для ізольованих поліядерних аренів також характерні реакції SE, які відбуваються спочатку в пара-, а потім в орто-положення:
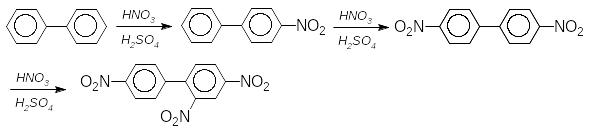
Біфеніл більш реакційно здатний ніж бензен
ВПЛИВ ЗАМІСНИКІВ НА НАПРЯМОК І ШВИДКІСТЬ РЕАКЦІЙ ЕЛЕКТРОФІЛЬНОГО ЗАМІЩЕННЯ В АРЕНАХ
В молекулі бензену електронна густина розподілена рівномірно, всі зв’язки рівноцінні, але з введенням замісника рівномірність розподілу -електронної густини порушується й відбувається її перерозподіл. Місце входження наступного замісника визначається електронною природою попереднього замісника, тому перший замісник називають орієнтантом.
Замісники поділяють на дві групи - замісники першого роду, які орієнтують в орто- і пара-положення, і замісники другого роду - мета-орієнтанти.
Замісники I роду поділяються на:
Слабкі орієнтанти. Ці орієнтанти виявляють +I-ефект, а їх мезомерний ефект виражений слабко або дорівнює нулю. До них відносять алкільні групи, фенільні групи, групу СН2СООН, СН2Сl та інші.
До середніх орієнтантів відносять групи:
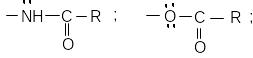 а
до сильних
орієнтантів:
а
до сильних
орієнтантів:
![]()
Усі ці орієнтанти,
окрім алкільних груп, містять гетероатоми
з вільною електронною парою й виявляють
+М-ефект.
Водночас ці ж замісники виявляють
I-ефект
(окрім О)
, але позитивний мезомерний ефект
перевищує негативний індуктивний ефект.
Унаслідок спряження вільних електронних
пар гетероатомів з -електронною
густиною бензенового я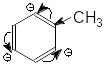 дра,
його електронна густина збільшується
й в орто-
і пара-положеннях
утворюються часткові негативні заряди.
Тобто такі замісники підвищують реакційну
здатність ароматичного ядра в реакціях
SE.
дра,
його електронна густина збільшується
й в орто-
і пара-положеннях
утворюються часткові негативні заряди.
Тобто такі замісники підвищують реакційну
здатність ароматичного ядра в реакціях
SE.
Н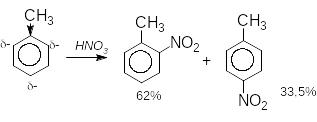 априклад:
априклад:
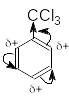
Серед замісників I роду є й такі, що дезактивують ароматичне ядро - це атоми галогенів. У статичному стані I-ефект галогену перевищує його +М-ефект (I). Але атоми галогенів мають вільні електронні пари й під час реакції в бензеновому ядрі відбувається зміна полярності зв’язків, атом галогену виявляє динамічний +М-ефект і має виражену орто- і пара-орієнтуючу дію (II):

Ця неузгодженість динамічних і статичних факторів знижує швидкість SE-реакцій, тому галогени хоч і є замісниками I роду, але вони значно зменшують реакційну здатність бензенового ядра. Отже SE-реакції для галогенаренів треба проводити в жорсткіших умовах.
До замісників II роду (електроноакцепторних) належать:
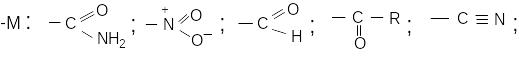
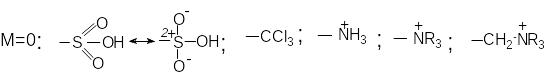
З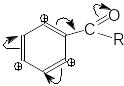
 амісники
II роду орієнтують вхід наступного
замісника в мета-положення.
Всі мета-орієнтанти
є електроноакцепторними групами,
виявляють I-ефект
(деякі М-ефект),
зменшуючи електронну густину в
ароматичному ядрі, при цьому в орто-
і пара-положеннях
утворюються часткові позитивні заряди.
Мета-орієнтанти
зменшують здатність ароматичного ядра
до реакцій електрофільного заміщення
(SЕ).
амісники
II роду орієнтують вхід наступного
замісника в мета-положення.
Всі мета-орієнтанти
є електроноакцепторними групами,
виявляють I-ефект
(деякі М-ефект),
зменшуючи електронну густину в
ароматичному ядрі, при цьому в орто-
і пара-положеннях
утворюються часткові позитивні заряди.
Мета-орієнтанти
зменшують здатність ароматичного ядра
до реакцій електрофільного заміщення
(SЕ).
Орієнтація заміщення не є абсолютною. Наприклад, при нітруванні нітробензену утворюється така суміш ізомерів:
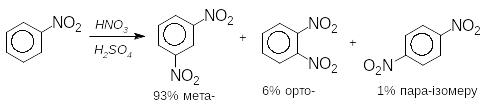
Є ще група замісників проміжного характеру, які не виявляють певної орієнтації, тому SE-реакції призводять до утворення суміші о-, п- і м-ізомерів. Це групи:
![]()
Порядок введення замісників до ароматичного ядра може мати значення в реакціях перетворення: