
- •Бийский технологический институт (филиал)
- •Потенциометрия
- •Содержание
- •1 Теоретическая часть
- •1. 1 Теоретические основы метода потенциометрии
- •1. 2 Электроды, используемые в потенциометрии
- •1. 3 Метод потенциометрического анализа
- •1. 4 Графические способы определения точки эквивалентности при титровании
- •2 Экспериментальная часть
- •2. 1 Лабораторная работа «Определение объёма кислоты в её растворе методом потенциометрического титрования» (6 часов)
- •2. 1. 1 Краткая характеристика метода
- •2. 1. 2 Необходимые реактивы
- •2.1. 3 Методика определения
- •2. 1. 3. 1 Определение концентрации гидроокиси натрия или калия
- •2. 1. 3. 2 0Пределение содержания кислоты в растворе
- •2. 3 Содержание отчета
- •3 Вопросы для защиты работы
- •4 Техника безопасности
- •Литература
- •Бийский технологический институт (филиал)
- •Потенциометрия
1. 2 Электроды, используемые в потенциометрии
Электроды, которые используются в потенциометрии, можно разделить на несколько видов.
Электроды первого рода обратимы относительно ионов металла, из которого выполнен электрод. Различают активные и инертные металлические электроды. Активные металлические электроды изготовляют из металлов, образующих восстановленную форму обратимой окислительно-восстановительной системы (Ag, Pb, Cu, Cd). Потенциал такого электрода является функцией активности собственных ионов в растворе, например для серебряного индикаторного электрода ( Ag+ + е Ag).
Если металлический электрод опустить в раствор соли этого металла, то образуется окислительно-восстановительная пара Меn+/Ме, потенциал которого можно измерить на потенциометре, а концентрацию (активность) металла можно рассчитать по уравнению Нернста:
φ
= φ0
+
![]() ,
(2)
,
(2)
где [Меn+] – активность ионов металла, моль/л.
Электроды второго рода чувствительны к изменению концентрации (активности) анионов в растворе и представляют собой металл, покрытый слоем нерастворимой соли металла с анионом (А-), к которому чувствителен электрод. При соприкосновении такого электрода с раствором, содержащим анион А-, возникает потенциал, который зависит от произведения растворимости соли и концентрации аниона:
φ
= φ0Ме+/Ме
+
![]() , (3)
, (3)
где [A-] – активность аниона А, моль/л.
К электродам второго рода относятся хлорсеребряный, каломельный электрод и другие.
Для определения концентрации (активности) ионов в растворе необходимо измерить электрохимический потенциал индикаторного электрода, погружённого в исследуемый раствор, относительно электрода сравнения.
Электродом сравнения называют электрод с известной и постоянной величиной электродного потенциала. Обычно в качестве электродов сравнения используют каломельный или хлоридсеребряный (хлорсеребряный) электрод.
Основной частью хлорсеребряного элект рода является погружённая в насыщенны раствор KCl серебряная проволока, покрытая слоем AgCl (рисунок 1).Контакт электрода с раствором осуществ-ляется через мостик из асбестовой нити, смоченной раствором KCl, с потенциометром – через серебряную проволоку.
Стандартный потенциал хлорсеребрянного электрода равен 0,22 В, каломельного электрода в насыщенном растворе KCl равен 0, 246 В, а в растворе KCl, концентрация которого 1 моль/дм3, – 0,280 В.
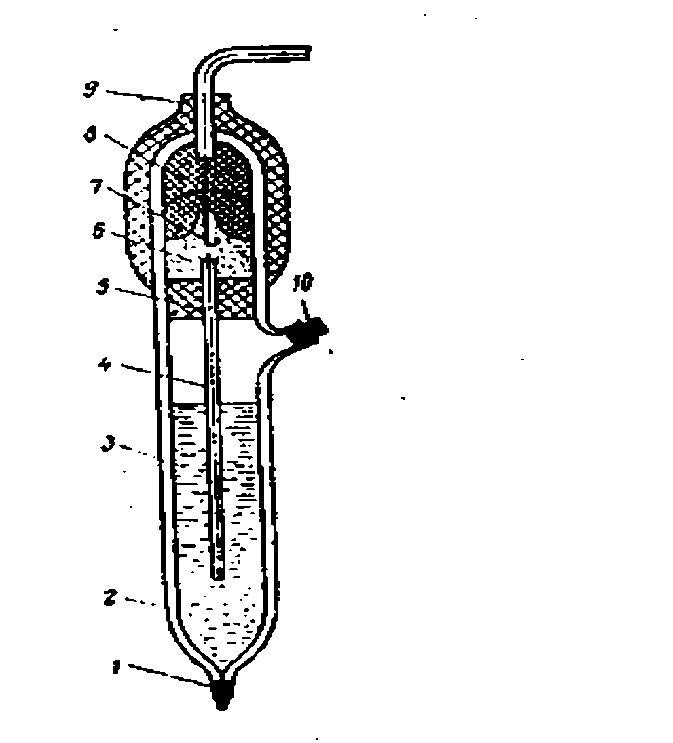
1─нить асбестовая; 2─корпус; 3─насыщенный раствор КCl; 4─электроли-тический ключ; 5, 8─резиновые пробки; 6─полость; 7─контактный полуэлемент; 9─колпачок; 10─пробка.
Рисунок 1Хлорсеребряный электрод (типа ЭВЛ-1 МТ)
Индикаторным электродом или электродом определения называют электрод, который обратим относительно активности анализируемого потенциалопределяющего иона. В качестве индикаторных электродов в последние годы используются ионселективные мембранные электроды.
Мембранные или ионоселективные электроды имеют мембрану, на которой возникает мембранный потенциал. Величина потенциала зависит от разности концентраций одного и того же иона по разные стороны мембраны. По материалу мембраны электроды подразделяются: стеклянные электроды, электроды с жидкими мембранами, электроды с твёрдыми или осадочными мембранами, электроды с газочувствительными мембранами. Широкое применение для определения кислотности нашёл такой мембранный электрод, как стеклянный (рисунок 2).
Стеклянные мембраны изготовляют из специальных стекол, подбирая их состав так, чтобы мембрана проявляла повышенную селективность к определенному иону и позволяла определять его в присутствии других.

1—стеклянная рН—чувствительная мембрана; 2—-0,1М раствор НС1; 3—-серебряная проволока, покрытая AgCl; 4—-стеклянная трубка; 5—изоляция; 6—токоотвод.
Рисунок 2—Стеклянный электрод для измерения рН
