
- •Бийский технологический институт (филиал)
- •Ионометрическое определение содержания нитрат– ионов в растворах
- •Бийский технологический институт (филиал)
- •Ионометрическое определение содержания нитрат–ионов в растворах
- •1 Цели и задачи при выполнении лабораторной работы
- •1. 2. 1 Работа над теоретической частью
- •1. 2. 2 Работа над экспериментальной частью
- •1. 2. 3 Обработка экспериментальных данных
- •2. 4 Выводы
- •Основной частью хлоридсеребряного электрода является погружённая в насыщенный раствор kCl серебряная проволока, покрытая слоем AgCl (рисунок 1).
- •5 Техника безопасности
- •Литература
- •Содержание
- •1. Цели и задачи при выполнении лабораторной работы………………..
2. 4 Выводы
Должны содержать сравнение полученных экспериментальных данных с теоретическими предпосылками, которые существуют по изучаемому вопросу. В случае отклонения экспериментальных данных от теоретических, необходимо обосновать причины расхождений.
Итогом работы является защита лабораторной работы. Защита проводится устно или письменно, но обязательно индивидуально.
2 ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
2. 1 Теоретические основы метода ионометрии
Ионометрия – потенциометрический метод определения содержания (активности) ионов, основанный на измерении электрохимического потенциала индикаторного электрода, погружённого в исследуемый раствор, относительно электрода сравнения.
Электродом сравнения называют электрод с известной и постоянной величиной электродного потенциала. Обычно в качестве электродов сравнения используют каломельный или хлоридсеребряный (часто называемый хлорсеребряным) электроды.
Основной частью хлоридсеребряного электрода является погружённая в насыщенный раствор kCl серебряная проволока, покрытая слоем AgCl (рисунок 1).
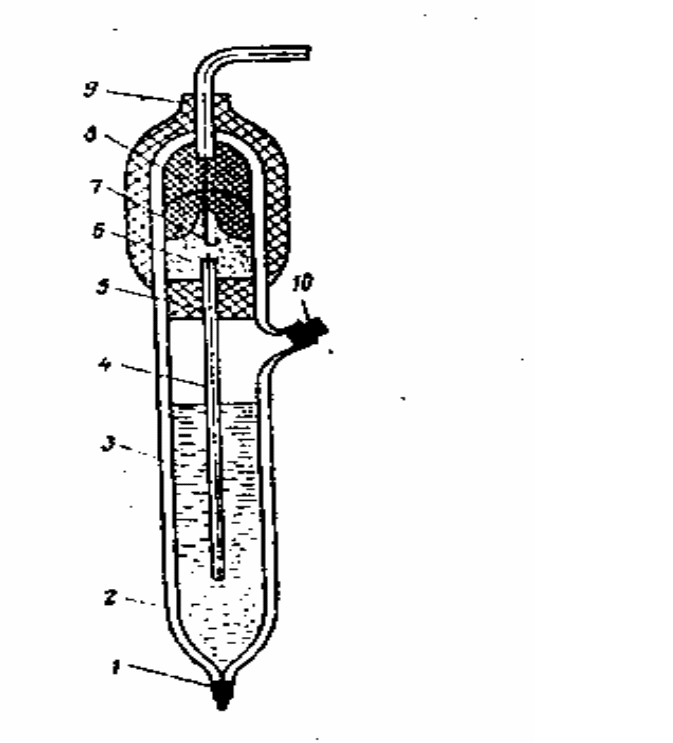
1 − нить асбестовая; 2 − корпус; 3 − насыщенный раствор КCl; 4 − электролитический ключ; 5, 8 − резиновые пробки; 6 − полость; 7 − контактный полуэлемент; 9 − колпачок; 10 − пробка.
Рисунок 1 - Хлоридсеребряный электрод (типа ЭВЛ1 - МТ)
Контакт электрода с раствором осуществляется через мостик из асбестовой нити, смоченной раствором KCl; а с потенциометром – через серебряную проволоку.
Потенциал такого электрода является функцией активности хлорид − ионов в растворе, так как в основе электрода лежит окислительно-восстановительная реакция:
AgCl (т) + е ®Ag (т) + Сl-.
В соответствии с уравнением Нернста потенциал хлоридсеребряного электрода равен:
φ = φ0AgCl/Ag,Cl- _ lg aCl-,
где aCl-– активность ионов хлора, моль/дм3.
В насыщенном растворе KCl молярная концентрация ионов хлора постоянна, и потенциал электрода равен 0,199 В.
Индикаторным электродом (или электродом определения) называют электрод, который обратим относительно активности анализируемого потенциалопределяющего иона. Так, при изменении рН раствора потенциал индикаторного электрода должен зависеть от активности ионов водорода в растворе. В качестве индикаторных электродов в последние годы используются ионоселективные мембранные электроды. Создание ионоселективных электродов (ИСЭ) способствовало интенсивному развитию прямого потенциометрического определения многих ионов в растворе. В настоящее время выпускают около 30 ИСЭ. Кроме давно применяемого стеклянного ионоселективного электрода для определения рН, используются электроды, чувствительные к ионам F-, Сl-, N03-, Вr-, I-, CN-, S2-, N03-, NН4+, Pb2+, Cu2+, Ni2+, K+, а также ИСЭ для определения газов (СО2, NH3, HC1, H2S, HCN, NO), мочевины и других азотсодержащих соединений. Важнейшей составной частью ионоселективного электрода является полупроницаемая мембрана. Это тонкая пленка, отделяющая внутреннюю часть электрода (внутренний раствор) от анализируемого раствора и обладающая способностью пропускать ионы только одного знака заряда (катионы или анионы). Во многих случаях эти мембраны проницаемы для ионов только одного вида в присутствии других ионов того же знака заряда.
При потенциометрических измерениях с использованием ИСЭ собирают гальванический элемент:
Электрод сравнения 1
|
Стандартный раствор
|
Мембрана
|
Анализируе-мый раствор
|
Электрод сравнения 2
|
Электродвижущую силу (ЭДС) собранного гальванического элемента можно измерить, применяя любые потенциометрические устройства, сконструированные на основе токоусилительных систем. Для этой цели служат иономеры и рН-метры.
Электродвижущую силу (ЭДС) собранного гальванического элемента можно измерить, применяя любые потенциометрические устройства, сконструированные на основе токоусилительных систем. Для этой цели служат иономеры и рН − метры.
В зависимости от материала, использованного для изготовления мембран, различают электроды с твердыми, стеклянными или жидкими мембранами.
Стеклянные мембраны изготавливают из специальных стекол, подбирая их состав так, чтобы мембрана проявляла повышенную селективность к определяемому иону. Первым электродом со стеклянной мембраной (рН − чувствительной мембраной) был электрод, селективный относительно ионов водорода, который вытеснил все другие электроды, применявшиеся для измерения рН среды. При погружении стеклянного электрода в раствор, рН которого отличается от рН внутреннего раствора, на стеклянной мембране возникает мембранный потенциал ем, который можно измерить, поместив в исследуемый раствор внешний хлоридсеребрянный электрод.
Стандартный потенциал стеклянного электрода Е° обычно не определяют. При использовании заводских рН − метров эта операция заменяется настройкой приборов по стандартным буферным растворам, т. е. шкала рН − метра проградуирована непосредственно в единицах рН (от 1 до 14).
Основными достоинствами стеклянного электрода являются простота работы, применимость в широкой области рН, быстрое установление равновесия и возможность определения рН в окислительно-восстановительных системах. Потенциометрическое определение рН находит широкое применение в технохимическом контроле пищевых продуктов, так как в основе технологии производства многих пищевых продуктов лежат биохимические и микробиологические процессы, существенно зависящие от рН среды.
Систематические исследования зависимости электродных свойств стекла от его состава показали, что определенным его изменением (введением оксидов бора, алюминия) можно получить стекло, электроды из которого селективны по отношению к ионам натрия, калия, аммония, серебра. Из них более широкое применение вследствие высокой селективности нашел натрийселективный электрод. С помощью этого электрода можно определять, например, NaCl в пищевых продуктах.
В электродах с твердой мембраной мембрану создают прессованием в виде диска или таблетки монокристаллических (например, LаFз) или поликристаллических трудно растворимых в воде солей (например, Ag2S или AgBr). В этих мембранах обычно один из двух составляющих соль ионов способен перемещаться в кристаллической решетке по ее дефектам. Поэтому электроды с твердой мембраной используются в качестве датчиков для определения тех ионов, которые входят в состав мембраны, а также тех ионов, которые способны взаимодействовать с активными центрами материала мембраны.
Первый твердофазный высокоселективный мембранный электрод был сконструирован с использованием монокристалла LaFз для определения активности ионов фтора (рисунок 2). Он нашел применение для определения фторид-иона в питьевой, морской и сточных водах, зубных пастах, в витаминах.

Рисунок 2 − Фторидселективный электрод
Электроды, чувствительные к ионам Ag+, S2-, Сu2+, РЬ2+, Cl-, Вr-, полу-чены на основе Ag2S (поскольку перечисленные ионы или замещают ион серебра, или связываются с ним на поверхности кристалла).
Твердые мембранные электроды могут быть не только гомогенными, но и гетерогенными. Гетерогенные мембраны содержат какой-либо связующий материал (матрицу) для придания электроду необходимой механической прочности. В качестве инертной матрицы используют парафин, силиконовый каучук, эпоксидные смолы, поливинилхлорид и другие материалы. Диспергированные в них соли обеспечивают возможность определения ионов, входящих в состав названных солей. В электродах с жидкой мембраной раствор сравнения отделен от анализируемого тонким слоем органической жидкости, представляющей собой раствор жидких ионитов или ионных ассоциатов в органических растворителях, не смешивающихся с водой, но селективно реагирующих с определяемым ионом. Электродоактивный слой получается пропиткой этой жидкостью пористой гидрофобной мембраны из пластика (рисунок 3).
Внутренний хлоридсеребряный электрод погружен в раствор, содержащий определяемый катион. Пористая мембрана одной стороной
соприкасается с раствором сравнения хлоридсеребрянного электрода, а другой с анализируемым раствором. Ионочувствительная жидкость в резервуаре, пропитывающая мембрану, состоит из жидкого органического ионита, имеющего кислотные, основные или хелатообразующие функциональные группы, растворённого в подходящем растворителе, несмешивающимся с водой.
Ассортимент жидкостных ИСЭ постоянно увеличивается. Известны электроды, селективные к катионам (Cu2+, Mg2+, Mn2+, NH4+), к анионам (CO32-, SO42- и др.), а также к ионогенным органическим соединениям. Среди них наиболе важными для решения экологических проблем являются электроды, селективные к поверхностно-активным веществам (определение загрязнения моющими средствами).
Недостатком ИСЭ с жидкими мембранами является их низкая механическая прочность.
В настоящее время сконструированы газочувствительные мембранные электроды для определения СО2, NH3, NO, H2S и других газов. В основе действия газовых электродов лежит реакция с участием воды, в результате которой изменяется характер среды, например:
СО2 + Н2О ↔ Н+ + НСО3-;
NH3 + H2O ↔OH- + NH4+.
Индикаторными ИСЭ на выделяющиеся при этих реакциях ионы (Н+, ОН-) служат стеклянные рН − электроды. Позднее появились ферментные, бактериальные и иммуноэлектроды, сочетающие чувствительность и селективность биохимической реакции со скоростью и простотой потенциометрического метода.
Благодаря большому разнообразию ИСЭ потенциометрическое определение ионов находит применение во многих областях: технике, медицине, экологической службе, сельском хозяйстве, пищевой промышленности. Так, ионометрически определяют ионы кальция в биологических жидкостях, воде, пищевых продуктах (детском питании, полуфабрикатах сахарного производства); ионы иода − в морской капусте и в других водорослях, нитрит − ионы - во всех видах пищевой продукции, в удобрениях и растениях.
2. 2 Основные приемы ионометрического анализа
Во всех приемах прямой потенциометрии используется зависимость потенциала индикаторного (обычно ионоселективного) электрода от активности определяемого иона. Активность определяемого иона может быть рассчитана по известным уравнениям. Однако, прямой расчет концентрации по активности иона не всегда можно сделать с необходимой точностью, так как ионная сила анализируемого раствора, от которой зависят коэффициенты активности, обычно неизвестна В связи с этим в практике используется несколько приёмов ионометрии: метод градуировочного графика, метода добавок и метода концентрационного элемента. Ниже излагается суть метода градуировочного графика как наиболее часто используемого в ионометрии.
2. 2. 1 Метод градуировочного графика
Для построения градуировочного графика измеряют ЭДС элемента при нескольких концентрациях определяемого иона и постоянной ионной силе. Затем определяют ЭДС, помещая индикаторный электрод в анализируемый раствор, и по ЭДС и градуировочному графику находят содержание иона в анализируемом растворе. Перед определением ЭДС в анализируемом растворе стремятся создать такой же солевой фон и ионную силу, какие были в стандартных растворах, использованных для построения градуировочного графика. Для этого в анализируемый раствор вводят определенный объем концентрированного раствора фонового электролита.
Успешно применяется метод градуировочного графика при анализе слабо минерализованных растворов, поскольку в таких пробах можно легко создать заданное значение ионной силы. На практике этот метод используется, например, при определении фторид-иона в питьевой воде с помощью фторид − селективного электрода.
2. 3 Ионометрический метод определения нитрат − ионов
Суть метода заключается в извлечении нитратов из анализируемого материала с последующим измерением их молярной концентрации (активности) в полученном растворе с помощью ионоселективного электрода. Мембранный нитратселективный электрод предназначен для измерения активности NO3- в водных растворах в лабораторной практике и промышленных условиях, в химической промышленности, в сельском хозяйстве, при контроле сточных вод.
Электрод рассчитан для работы в качестве индикаторного в паре с любым вспомогательным электродом (например, хлоридсеребряным) в комплекте с рН-милливольтметрами и иономерами. Контролируемая среда не должна образовывать плёнок и осадков на рабочей части (мембране) электрода и не должна содержать ионы Br- и J-. Электрод селективен в присутствии таких ионов, как Cl-, HCO3-, CH3COO-, F- и SO42- при превышении их массовой доли над массовой долей ионов NO3- соответственно в 100, 500, 500, 1000 и 1000 раз.
Конструктивно нитрат − селективный электрод (рисунок 3) состоит из кон-тактного полуэлемента (4), поливинилхлоридного корпуса (3), к торцевой части которого прикреплена мембрана 1. Корпус электрода заполняется приэлект-родным раствором 2, содержащим от 10-1до 5. 10-3 моль KNO3 и 10-1 моль KCl в 1 дм3 раствора. Электрод имеет для подключения к измерительному прибору
родным раствором 2, содержащим от 10-1до 5. 10-3 моль KNO3 и 10-1 моль KCl в 1 дм3 раствора. Электрод имеет для подключения к измерительному прибору
кабельный наконечник 5. В случае подключения к лабораторным приборам в комплекте электрода предусмотрен штеккер 6.
Принцип работы электрода основан на том, что при его погружении в раствор происходит обмен ионами между поверхностью ионочувствительной мембраны и раствором. При этом между поверхностью мембраны и измеряемым раствором возникает разность потенциалов, значение которой пропорционально значению pNO3 измеряемого раствора. Измерение потенциала электрода, погружённого в раствор, позволяет определить pNO3, а следовательно и активность (концентрацию) ионов NO3- в анализируемом растворе.
Чувствительность метода составляет 6 мг нитратов на 1 дм3 анализируемого раствора, нижний предел определения нитратов в анализируемом растворе 30 мг/кг.

1 − мембрана; 2 − приэлектродный раствор; 3 − поливинилхлоридный корпус; 4 − контактный полуэлемент; 5 − кабельный наконечник; 6 − штеккер.
Рисунок 3 − Ионоселективный мембранный электрод ЭМ – NO3 – 01
Определение нитратов а водных растворах не требует их предварительной подготовки. При анализе растительного сырья из анализируемого материала
предварительно извлекают нитраты раствором алюмокалиевых квасцов и определяют их содержание в полученной вытяжке с помощью ионоселективного электрода. В некоторых случаях для разрушения примесей, мешающих определению нитратов, дополнительно проводят их окисление, а иногда – необходимо фильтрование вытяжки и её разбавление.
3 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ: «Определение содержания нитрат − ионов водных растворов ионометрическим методом» (6 часов)
Цель работы: освоить основные операции метода прямой потенциометрии и определить содержание нитрат − ионов в водном растворе с помощью мембранного ионоселективного электрода
3. 1 Краткая характеристика метода
Метод основан на прямом потенциометрическом определении нитрат-ионов в растворах, содержащих ион NO3- в интервале от 0,1 до 0,0001 моль/дм3. Содержание нитрат-ионов в анализируемом растворе находят с помощью метода градуировочного графика. С этой целью готовят серию растворов с известным содержанием нитрат-ионов, измеряют их потенциал и строят график, откладывая по оси абсцисс величины рСNO3, а по оси ординат – Е (ЭДС), мв, который в координатах должен быть линеен. Затем определяют ЭДС, помещая индикаторный электрод в анализируемый раствор, и по ЭДС и градуировочному графику находят содержание нитрат-иона в анализируемом растворе.
Для проведения анализа необходимы растворы, указанные в 3. 2, а так же иономер или потенциометр любого типа.
3. 2 Необходимые аппаратура, материалы и реактивы
В данной работе используются:
1) иономер типа «ЭВ -74» или рН-метр «рН – 121», или аналогичные приборы с погрешностью измерений не более 5 мв (0,05 pCNO3);
2) ионоселективный нитратный электрод ЭМ-NO3 или другой, имеющий такие же метрологические характеристики;
3) электрод сравнения хлорсеребряный насыщенный образцовый второго ра разряда (ГОСТ 17792-72);
4) весы АДВ–200 или другие лабораторные весы общего назначения четвёртого класса точности, максимальный предел взвешивания 200 г (ГОСТ 24104-80);
5) мешалка лабораторная электромеханическая;
6) колбы мерные второго класса точности вместимостью 100 см3 - 5 штук;
7) калий хлористый (ГОСТ 4329-77), ч.д.а.;
8) Калий азотнокислый (ГОСТ 4217-77), х.ч.
9) Вода дистиллированная (ГОСТ 6709-72).
3. 3 Подготовка к работе
3. 3. 1 Приготовление растворов нитрата калия для построения калибровочного графика
3. 3. 1. 1 Приготовление раствора 0,1 моль/дм3 азотнокислого калия
10,11 г азотнокислого калия, высушенного при температуре 100…1050 С до постоянной массы, взвешивают с точностью до второго десятичного знака, помещают в мерную колбу вместимостью 1000 см3, растворяют в дистиллированной воде и доводят объём до метки дистиллированной водой.
3. 3. 1. 2 Приготовление растворов сравнения азотнокислого калия
Раствор сравнения, содержащий 0,1 моль/дм3 нитрат − ионов, готовят из
1 моль/дм3 раствора азотнокислого калия. Для этого в колбу вместимостью 100 см3 отбирают пипеткой 10 см3 раствора с концентрацией 1 моль/дм3 доводят раствор до метки дистиллированной водой и перемешивают.
Раствор сравнении, содержащий 0,01 моль/дм3 нитрат – ионов, готовят из
0,1 моль/дм3 раствора азотнокислого калия. Для этого в колбу вместимостью 100 см3 отбирают пипеткой 10 см3 раствора с концентрацией 0,1 моль/дм3, доводят раствор до метки дистиллированной водой и перемешивают.
Раствор сравнения, содержащий 0,005 моль/дм3 готовят из 0,1 моль/дм3 раствора азотнокислого калия. Для этого в колбу вместимостью на 100 см3 отбирают 5 см3 раствора с концентрацией 0,1 моль/дм3, доводят раствор до метки дистиллированной водой и перемешивают.
Раствор сравнения, содержащий 0,001 моль/дм3 готовят из 0,01 моль/дм3 раствора азотнокислого калия. Для этого в колбу вместимостью 100 см3 отбирают пипеткой 10 см3 раствора с концентрацией 0,01 моль/дм3, доводят раствор до метки дистиллированной водой и перемешивают.
Раствор сравнения, содержащий 0,0001моль/дм3 готовят из 0,001 моль/дм3 раствора азотнокислого калия. Для этого в колбу вместимостью 100 см3 отбирают пипеткой 10 см3 с концентрацией раствора 0,001моль/дм3, доводят раствор до метки дистиллированной водой и перемешивают.
Растворы сравнения, приготовленные указанным выше способом, используют для градуировки прибора, проверки электродов, построения градуировочного графика.
3. 3. 2 Подготовка мембранного ионоселективного нитратного электрода и хлоридсеребряного электрода сравнения к работе.
В промежутках между исследованиями мембранный ионоселективный электрод погружают в дистиллированную воду. Если перерывы в работе составляют сутки или более, его хранят в растворе азотнокислого калия с концентрацией 0,1 моль/дм3.
Хлоридсеребряный электрод сравнения в перерывах между исследованиями хранят погружённым в дистиллированную воду.
3. 4 Определение содержания нитрат − ионов в растворе
3. 4.1 Построение градуировочного графика
После подключения прибора к электросети подготовленные к работе нитратный и хлорсеребряный электроды промывают дистиллированной водой, затем раствором нитрата калия с концентрацией 0,0001 моль/дм3. Затем в чистый стакан наливают раствор нитрата калия той же концентрации, погружают в раствор электроды, якорь магнитной мешалки, включают магнитную мешалку в сеть и регулируют скорость перемешивания раствора.
На панели потенциометра включают клавишу предела измерений «1…14», а затем клавишу «mV» и определяют первоначальное (приблизительное) значение ЭДС по нижней шкале прибора. После этого включают клавишу узкого диапазона измерений и определяют точное значение ЭДС раствора по верхней шкале прибора.
Затем последовательно измеряют ЭДС растворов, содержащих растворы нитрата калия с концентрацией 0,005 моль/дм3, 0,001моль/дм3, 0,01моль/дм3, 0,1 моль/дм3 и 1 моль/дм3.Перед каждым измерением выдерживают электроды в исследуемом растворе не менее 2…3 минут.
Результаты измерений заносят в таблицу (таблица 1), строят график, откладывая по оси абсцисс величины рСNO3, а по оси ординат – Е (ЭДС), мв.
Таблица 1 − Значения рNO3 контрольных растворов и потенциалов (ЭДС) нитрат-селективного электрода
С(KNO3) |
10-4 |
10-3 |
5.10-3 |
10-2 |
10-1 |
1 |
pNO3 |
4,00 |
3,02 |
2,75 |
2,05 |
1,19 |
0,35 |
Е (ЭДС), мв |
|
|
|
|
|
|
3. 4. 2 0пределение содержания нитрат − ионов в анализируемом растворе
В стакан с испытуемым раствором погружают электроды и якорь магнит-
ной мешалки так, чтобы якорь не касался электродов.
Включают магнитную мешалку в сеть и регулируют скорость перемешивания. На панели рН-метра включают клавишу диапазона измерений «1 − 14» и определяют первоначальное значение mV.
Проводят не менее трех параллельных определений, каждый раз записывая значения ЭДС анализируемого раствора. После окончания работы включают кнопку «Од», поднимают держатель с электродами, выключают магнитную мешалку и рН-метр из сети. Промывают электроды дистиллированной водой.
Нитрат − селективный электрод хранят в растворе нитрата калия с концентрацией 0,1 моль/дм3.
3. 4. 3 Обработка результатов измерений
Массовую долю нитрат − ионов в испытуемом растворе (Х) в моль/дм3 рассчитывают по формуле:
Х = l0-рNO3,
где l0-рNO3 – молярная концентрация нитрат − ионов в анализируемом растворе, найденная с помощьюградуировочного графика.
По результатам трёх опытов определяют среднее значение, а так же оценивают точность и правильность полученных результатов, рассчитывая относительную и абсолютную ошибки анализа и доверительный интервал.
4 КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. На чем основан потенциометрический метод анализа?
2. Каково назначение и принцип работы стеклянного электрода?
3. Каково устройство и назначение хлорсеребряного электрода?
4. Какая зависимость выражается уравнением Нернста?
5. Какие функции выполняют индикаторный электрод, а какие – электрод сравнения?
6. Как устроен стеклянный электрод? Как с его помощью определяют рН раствора?
7. Каковы основные типы ионоселективных электродов? Как они устроены?
8. Какие характеристики имеют ионоселективные электроды?
9. Какие способы определения концентрации ионов с помощью ионоселек-тивных электродов вы знаете?
10. В чём заключается суть метода градуировочного графика?
11. Каково устройство нитрат − селективного электрода?
10. Почему потенциал нитрат − селективного электрода зависит от активности нитрат − ионов?
11. В каких координатах строят градуировочный график при определении нитрат − ионов?
12. Как рассчитывается молярная концентрация нитрат − ионов в растворе?
13. Как оценивается правильность и воспроизводимость метода анализа?
