
- •Основные классы неорганических соединений.
- •Классификация оксидов
- •Кислотные оксиды
- •Способы получения кислотных оксидов.
- •Физические свойства кислотных оксидов
- •1. Агрегатное состояние.
- •2. Растворимость кислотных оксидов.
- •3. Цвет кислотных оксидов.
- •4. Запах кислотных оксидов.
- •Химические свойства кислотных оксидов.
- •Основные оксиды
- •Способы получения основных оксидов
- •Физические свойства основных оксидов
- •Цвет основных оксидов
- •Химические свойства основных оксидов
- •Амфотерные оксиды
- •Способы получения амфотерных оксидов
- •Физические свойства амфотерных оксидов
- •Цвет амфотерных оксидов
- •Химические свойства амфотерных оксидов
- •Несолеобразующие оксиды
- •Оксид углерода (II) co
- •Физические свойства со
- •Токсические свойства со
- •Способы получения со
- •Химические свойства со
- •Оксид азота (II) no
- •Физические свойства no
- •Способы получения no
- •Химические свойства оксида азота II – no
- •Оксид азота (I) − n2o
- •Зависимость растворимости некоторых газов от их природы и температуры
- •Способы получения n2o
- •Химические свойства n2o
- •Содержание
Оксид азота (II) no
Ниже приведено электронное и пространственное строение оксида азота (II).
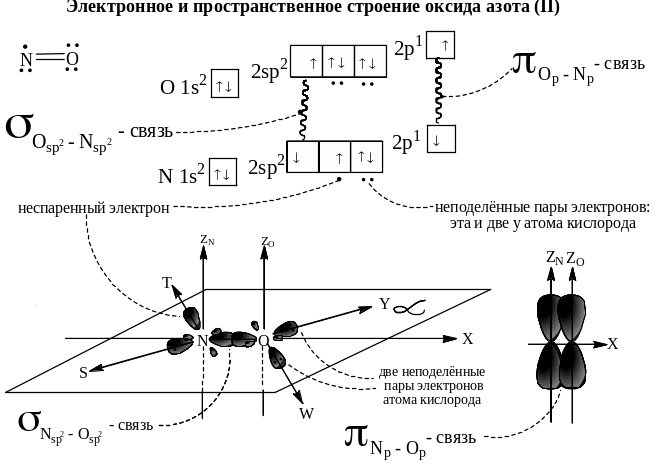
Оси X, Y, S, T и W лежат в плоскости α. Оси Z перпендикулярны этой плоскости. Углы между осями S и X, S и T близки к 120О. Ось Y параллельна оси S, ось W параллельна оси T.
Физические свойства no
Оксид азота II – NO представляет собой бесцветный газ, который при – 151.7ОC сжимается в голубую жидкость. Последняя уже при – 163,6ОC отвердевает. Так как оксид азота II имеет неспаренный электрон, то в жидком состоянии он на 25% димеризован, а в твёрдом является на 100% димером N2O2:
![]()
В воде растворяется плохо; растворимость довольно резко падает с ростом температуры:
V0s = 7, 38 мл / 100 г воды; V20s = 4,71 мл / 100 г воды; V80s = 2,70 мл / 100 г воды
Запах NO неизвестен, так как на воздухе он быстро окисляется до резко пахнущего NO2 , запах которого, наоборот, известен любому химику, так как именно им пахнет концентрированная азотная кислота.
Способы получения no
Оксид азота II NO может быть получен:
Прямым синтезом из простых веществ в электрической дуге:
N2
+ O2
![]() 2 NO
– Q
2 NO
– Q
Процесс эндотермичен.
В промышленности NO получают сжиганием аммиака в присутствии катализаторов:
4
NH3
+
5
O2
![]() 4
NO
+
6
H2O
4
NO
+
6
H2O
При сжигании аминов также получается NO:
4
CH3
– NH2
+ 11 О2
![]() 4 CO2
+ 10 H2O
+ 4 NO
4 CO2
+ 10 H2O
+ 4 NO
При взаимодействии нитритов металлов с концентрированной серной кислотой, например:
2
NaNO2(насыщ.)
+
H2SO4
(конц
)
![]() Na2SO4
+
NO↑ + NO2↑
+ H2O
Na2SO4
+
NO↑ + NO2↑
+ H2O
При разложении оксида азота (III):
N2O3 (синяя жидк.) NO↑ + NO2↑( бурый газ)
При восстановлении нитритов в кислой среде, например:
2 NaNO2 + 2 NaI + 2 H2SO4 (разб.) → 2 NO↑ + I2↓ + 2 Na2SO4 + 2 H2O
2 KNO2 + 2 FeSO4 + 2 H2SO4 → 2 NO↑ + Fe2(SO4)3 + K2SO4 + 2 H2O
При восстановлении разбавленной азотной кислоты тяжёлыми металлами (Ag, Cu, Pb, Ni, Mn, Hg и др.), например:
8 HNO3 (разб) + 3 Cu → 3 Cu(NO3)2 + 2 NO↑ + 4 H2O
. 8. При окислении «царской водкой» благородных металлов (Au, Pt, Rh)
3 Pt + 18 HCl (конц.) + 4 HNO3 (конц.) → 3 H2[PtCl6] + 4 NO↑ + 8 H2O
9. При разложении хлорида нитрозила:
2
NOCl
![]() 2 NO↑
+
Cl2↑
2 NO↑
+
Cl2↑
При гидролизе трифторида азота происходит диспропорционирование азота:
![]()
При взаимодействии фторида или хлорида нитрозила с красным фосфором, кремнием, металлами:
5 NOF + P(красн.) → 5 NO↑ + PF5 4 NOF + Si → 4 NO↑ + SiF4
3 NOCl + Fe → FeCl3 + 3 NO↑
Химические свойства оксида азота II – no
Оксид азота II – NO самый стабильный из всех оксидов азота. Но и он при катализе оксидом бария распадается на простые вещества при 700ОС:
2
NO
![]() N2
+ O2
N2
+ O2
NO медленно диспропорционирует, контактируя с твёрдой щёлочью:
![]()
Оксид азота II может быть окислителем:
2
NO + 2 H2
![]() 2 H2O
+ N2
2 H2O
+ N2
2 NO + 5 Zn + 10 NaOH(конц.) + 10 H2O → 2 (NH3 • H2O) + 5 Na2[Zn(OH)4]
2
NO + 2 H2S
→ N2
+ 2 H2O
+ 2 S↓ 2 NO + 2 SO2
![]() N2
+ 2 SO3
N2
+ 2 SO3
2
NO + C
![]() N2
+ CO2
10
NO + 4 P
5 N2
+ P4O10
N2
+ CO2
10
NO + 4 P
5 N2
+ P4O10
2 NO + 4 Cu N2 + 2 Cu2O (кирпично-красный)
и восстановителем:
2 NO + O2 → 2 NO2 2 NO + 3 HClO + H2O → 2 HNO3 + 3 HCl
NO + O3 → NO2 + O2 2 NO + 2 CrO3 + 3 H2SO4 → 2 HNO3 + Cr2(SO4)3 + 2 H2O
NO может вытеснять угарный газ – СО из карбонильных комплексов:
4 NO + [Fe(CO)5] (жёлт.жидк.) ——→ 5 CO↑ + [Fe(NO)4] (чёрн.тв.в-во)
NO может вступать в реакции соединения:
с галогенами:
2 NO + Сl2 (Br2) → 2 O = N – Cl (хлористый нитрозил (бромистый))
с оксидом азота IV:
NO
+ NO2
![]() N2O3
N2O3
сам с собой, давая димер:
NO
+ NO
![]() N2O2
N2O2
