
- •Основные классы неорганических соединений.
- •Классификация оксидов
- •Кислотные оксиды
- •Способы получения кислотных оксидов.
- •Физические свойства кислотных оксидов
- •1. Агрегатное состояние.
- •2. Растворимость кислотных оксидов.
- •3. Цвет кислотных оксидов.
- •4. Запах кислотных оксидов.
- •Химические свойства кислотных оксидов.
- •Основные оксиды
- •Способы получения основных оксидов
- •Физические свойства основных оксидов
- •Цвет основных оксидов
- •Химические свойства основных оксидов
- •Амфотерные оксиды
- •Способы получения амфотерных оксидов
- •Физические свойства амфотерных оксидов
- •Цвет амфотерных оксидов
- •Химические свойства амфотерных оксидов
- •Несолеобразующие оксиды
- •Оксид углерода (II) co
- •Физические свойства со
- •Токсические свойства со
- •Способы получения со
- •Химические свойства со
- •Оксид азота (II) no
- •Физические свойства no
- •Способы получения no
- •Химические свойства оксида азота II – no
- •Оксид азота (I) − n2o
- •Зависимость растворимости некоторых газов от их природы и температуры
- •Способы получения n2o
- •Химические свойства n2o
- •Содержание
Несолеобразующие оксиды
Несолеобразующими называются такие оксиды, которые в обычных условиях и в водных растворах (даже при нагревании их) не реагируют ни с кислотами, ни со щелочами.
Естественно, что из них в этих условиях не образуются соли в отличие от кислотных, основных и амфотерных оксидов. Иногда эти оксиды называют так же инертными, безразличными и индифферентными. Эти названия явно плохие, так как противоречат высокой реакционной способности этих оксидов в реакциях окисления, восстановления, комплексообразования и других реакциях.
К несолеобразующим оксидам относят оксид углерода (II) CO, оксид азота (II) NO, оксид азота (I) N2O и некоторые другие.
Оксид углерода (II) co
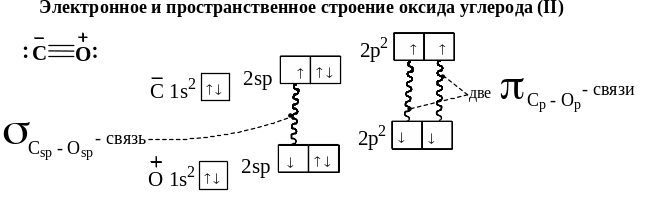
Электронное и пространственное строение оксида углерода (II) приведено ниже. Как видно между атомом углерода и кислорода три ковалентные полярные связи: одна σ и две π-связи. Атом кислорода заряжен положительно, а атом углерода отрицательно. То есть между ними и ионная, и ковалентные связи. Таким образом, мы имеем здесь дело с особым случаем семиполярной связи. Ещё ниже изображено строение комплексного соединения [Fe(CO)5], в котором в качестве лигандов, удерживаемых атомом железа находятся молекулы СО.


Координационные связи с центральным атомом железа за счёт неподеленной пары электронов у атома углерода в молекуле угарного газа. Ось Z перпендикулярна плоскости α, оси X, Y и W лежат в этой плоскости под углами 120о друг к другу.
Физические свойства со
СО – газообразное при обычных условиях, бесцветное, не имеющее запаха вещество, которое сжижается при – 191,50С (tкип) и отвердевает при – 2050С (tпл).
Угарный газ плохо растворим в воде: νs20 = 2, 32 мл/100 г воды νs 80 = 1,43 мл/100 г воды.
Растворимость СО повышается при наличие в воде HCl и NH3. Она выше, чем в воде, в низших спиртах и кетонах. Так, например, при 0,25ОС νs = 20, 4 мл/100 г этанола.
Хорошо растворяется СО также в хлористом метилене CH2Cl2.
Токсические свойства со
Угарный газ очень токсичен, так как СО более прочно связывается с ионом железа в гемоглобине и тот перестаёт переносить кислород из легких в другие части организма. В первую очередь от кислородного голодания страдает центральная нервная система. Человек безболезненно теряет сознание и, если во время не предпринять экстренные меры, умирает. Часто люди угорают в банях и зимой при регулировке двигателей в закрытых гаражах.
Способы получения со
Прямым синтезом из простых веществ:
2
C
+
O2
![]() 2
CO
2
CO
При взаимодействии паров воды с раскалённым углем (получение водяного газа):
H2O
(пар)
+ C
(раскал.)
![]() CO
+ H2
CO
+ H2
При взаимодействии углекислого газа с раскаленным углем:
С + СО2 2 СО
При получении некоторых карбидов из соответствующих оксидов и угля при высоких температурах:
CaO
+ 3 C
![]() CaC2
+ СО↑
2 Al2O3
+ 9 C
CaC2
+ СО↑
2 Al2O3
+ 9 C
![]() Al4C3
+ 6 CO↑
Al4C3
+ 6 CO↑
При получении металлов из карбонатов:
2 С + Na2CO3 2 Na + 3 СО↑
Путем разложения многих веществ:
а) муравьиной кислоты (лабораторный способ получения СО)

Интересно отметить, что муравьиная кислота может разлагаться иначе при смене катализатора:

б) карбонильных комплексов:
[K(CO)2]
![]() K + 2 СО↑
[Ag(CO)3]
K + 2 СО↑
[Ag(CO)3]
![]() Ag + 3 СО↑
Ag + 3 СО↑
[Ni(CO)4](бесцв.
жидк.)
![]() Ni + 4 СО↑
[Fe(CO)5](жёлт.
жидк.)
Fe
+ 5 СО↑
Ni + 4 СО↑
[Fe(CO)5](жёлт.
жидк.)
Fe
+ 5 СО↑
[W(CO)6](бел.
тв. в-во)
![]() W
+ 6 СО↑ (аналогично с Mо
при t
= + 155ОC)
W
+ 6 СО↑ (аналогично с Mо
при t
= + 155ОC)
