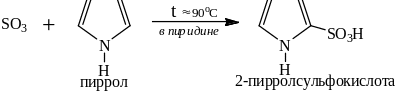- •Основные классы неорганических соединений.
- •Классификация оксидов
- •Кислотные оксиды
- •Способы получения кислотных оксидов.
- •Физические свойства кислотных оксидов
- •1. Агрегатное состояние.
- •2. Растворимость кислотных оксидов.
- •3. Цвет кислотных оксидов.
- •4. Запах кислотных оксидов.
- •Химические свойства кислотных оксидов.
- •Основные оксиды
- •Способы получения основных оксидов
- •Физические свойства основных оксидов
- •Цвет основных оксидов
- •Химические свойства основных оксидов
- •Амфотерные оксиды
- •Способы получения амфотерных оксидов
- •Физические свойства амфотерных оксидов
- •Цвет амфотерных оксидов
- •Химические свойства амфотерных оксидов
- •Несолеобразующие оксиды
- •Оксид углерода (II) co
- •Физические свойства со
- •Токсические свойства со
- •Способы получения со
- •Химические свойства со
- •Оксид азота (II) no
- •Физические свойства no
- •Способы получения no
- •Химические свойства оксида азота II – no
- •Оксид азота (I) − n2o
- •Зависимость растворимости некоторых газов от их природы и температуры
- •Способы получения n2o
- •Химические свойства n2o
- •Содержание
Физические свойства кислотных оксидов
1. Агрегатное состояние.
При нормальных условиях (P = 760 мм.рт.ст. = 101,3 кПа и t = 100оС = 273 K) часть кислотных оксидов являются газами. Это, например, CO2, SO2, NO2.
Cl2O, ClO2 и SO3 при н.у. жидкости, но ещё до достижения комнатной температуры (от 18оС) становятся газами.
Жидкостями при н.у. являются Cl2O7 и N2O3. При комнатной температуре жидкостями являются так же Mn2O7 (tпл = 5,9оC), ClO3 (tпл = 3,5 оC) и SO3 (tпл = 16,8 оC), причем SO3 существует как жидкость в довольно узком интервале температур, так как при 44,7 оС закипает и становится газом. Твёрдыми при н.у. являются, например, такие кислотные оксиды как: B2O3, SiO2, P4O6, P4O10, CrO3, N2O5, I2O5, Sb2O5, SeO2, SeO3, TeO2, TeO3.
Некоторые кислотные оксиды термически нестабильны и разлагаются при лёгком нагревании:
Mn2O7
![]() Mn2O3
+ 2 О2↑
Mn2O3
+ 2 О2↑
2. Растворимость кислотных оксидов.
Есть кислотные оксиды практически нерастворимые в воде: B2O3, SiO2, ограничено растворимые в воде, после чего начинается медленно идущая реакция:
SO2 + H2O H2SO3 CO2 + H2O H2CO3 2 NO2 + H2O → HNO3 + HNO2
Есть кислотные оксиды, бурно реагирующие с водой: Cl2O7, Mn2O7, SO3, P4O10.
Некоторые кислотные оксиды хорошо растворяются в неорганических растворителях: Cl2O7 и Mn2O7 в SnCl4 (оловянном масле) и CCl4 . SeO3 хорошо растворяется в жидком SO2 и в уксусном ангидриде, CO2 и SO2 хорошо растворяются в низших спиртах. CO2 очень хорошо растворяется в смеси этаноламина HO − CH2 − CH2 −NH2 и диэтаноламина HO − CH2 − CH2 − NH − CH2 − CH2 − OH, что используется для очистки воздуха от CO2 на подводных лодках.
3. Цвет кислотных оксидов.
Многие кислотные оксиды бесцветны : SO2, CO2, SO3, B2O3, P4O6, P4O10, I2O5, N2O5.
Многие окрашены: N2O3 – синяя жидкость, NO2 – бурый газ, CrO3 – оранжево-красные кристаллы, Mn2O7 – в проходящем свете чайно-красного цвета, в отраженном – зелёного.
4. Запах кислотных оксидов.
Многие кислотные оксиды не пахнут, например SiO2, CO2, B2O3, I2O5, Sb2O5 .
Другие имеют запах: SO2 – сгоревшей спички, SO3 – специфический резкий запах. NO2 имеет запах концентрированный азотной кислоты. Cl2O – напоминает запах хлора, известный каждому по запаху гипохлорита кальция Ca(ClO)2 (хлорки).
Химические свойства кислотных оксидов.
1. Большинство кислотных оксидов реагирует с водой, давая при этом кислоты, в которых элемент из оксида находится в той же степени окисления:
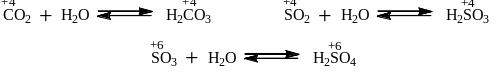
Некоторые кислотные оксиды, реагируя с водой в различных условиях, дают разные кислоты:
P4O10
+ 2 H2O
![]() 4 HPO3
P4O10
+ 6 H2O
4 HPO3
P4O10
+ 6 H2O
![]() 4 H3PO4
+ Q
4 H3PO4
+ Q
Другие кислотные оксиды, реагируя с водой, дают две кислоты, в которых степень окисления ниже и выше исходной (диспропорционирование):
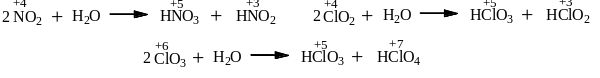
Имеются кислотные оксиды не реагирующие с водой ни при каких условиях. Это, например, оксид кремния – SiO2
2. Кислотные оксиды реагируют со щелочами, как в растворах:
SO2 + NaOH → NaHSO3 SO2 + 2 NaOH → Na2SO3 + H2O,
так и при сплавлении:
SiO2 + 2 KOH K2SiO3 + H2O↑
3. Кислотные оксиды реагируют с нерастворимыми в воде основаниями:
3 SO3 + 2 La(OH)3 → La2(SO4)3 + 3 H2O
и амфотерными гидроксидами:
Cl2O7 + Cu(OH)2 → Cu(ClO4)2 + H2O
4. Кислотные оксиды реагируют с основными оксилами:
6 Na2O + P4O10 → 4 Na3PO4 CaO + N2O5 → Ca(NO3)2
5. Они реагируют также и с амфотерными оксидами:
Al2O3 + 3 SO3 → Al2(SO4)3 ZnO + Mn2O7 → Zn(MnO4)2
6. Кислотные оксиды могут реагировать в растворе с солями, соответствующими более слабой кислоте с вытеснением оксида:
Na2CO3 + SO3 → Na2SO4 + CO2 ↑ Na2SiO3 + CO2 → Na2CO3 + SiO2 ↓
При сплавлении, наоборот, оксид, соответствующий более стойкой, хотя и более слабой кислоте, вытесняет оксид, соответствующий менее стойкой, хотя и более сильной кислоте.
Na2CO3 + SiO2 Na2SiO3 + CO2↑.
7. Кислотные оксиды реагируют с гидроксил и аммиак содержащими комплексами:
2 Na[Al(OH)4] + CO2 → Na2CO3 + 2 Al(OH)3 ↓ + H2O
[Ni(NH3)6](OH)2 + 4 SO2 + H2O → NiSO3 + 3 (NH4)2SO3
8. Некоторые кислотные оксиды могут участвовать в окислительно-восстановительных реакциях:
![]()
![]()
![]()
9. Кислотные оксиды могут также вступать в обменные реакции с кислотами:
P4O10 + 4 HNO3 → 4 HPO3 + 2 N2O5 P4O10 + 4 HClO4 → 4 HPO3 + 2 Cl2O7
10. Некоторые кислотные оксиды вступают в реакции соединения с кислотами. Очень важна реакция получения олеума – смеси серной, дисерной, трисерной и тетрасерной кислот:
SO3 + H2SO4 → H2S2O7 SO3 + H2S2O7 → H2S3O10 SO3 + H2S3O10 → H2S4O13
Из декаоксида тетрафосфора (фосфорного ангидрида) и ортофосфорной кислоты можно получить пирофосфорную кислоту:
P4O10 + 8 H3PO4 → 6 H4P2O7
11. Некоторые кислотные оксиды вступают в реакции с органическими веществами. Например: CO2 с солями ацетилена и терминальных алкинов:
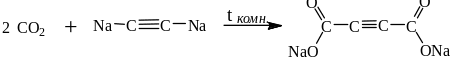
![]()
Он же с фенолятами (реакция Кольбе-Шмитта):
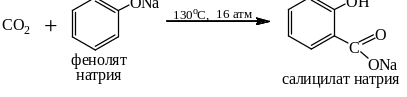
Оксид серы IV – SO3 сульфирует в пиридине фуран и пиррол, которые в силу их ацидофобности сульфировать серной кислотой нельзя: