
- •Основные классы неорганических соединений.
- •Классификация оксидов
- •Кислотные оксиды
- •Способы получения кислотных оксидов.
- •Физические свойства кислотных оксидов
- •1. Агрегатное состояние.
- •2. Растворимость кислотных оксидов.
- •3. Цвет кислотных оксидов.
- •4. Запах кислотных оксидов.
- •Химические свойства кислотных оксидов.
- •Основные оксиды
- •Способы получения основных оксидов
- •Физические свойства основных оксидов
- •Цвет основных оксидов
- •Химические свойства основных оксидов
- •Амфотерные оксиды
- •Способы получения амфотерных оксидов
- •Физические свойства амфотерных оксидов
- •Цвет амфотерных оксидов
- •Химические свойства амфотерных оксидов
- •Несолеобразующие оксиды
- •Оксид углерода (II) co
- •Физические свойства со
- •Токсические свойства со
- •Способы получения со
- •Химические свойства со
- •Оксид азота (II) no
- •Физические свойства no
- •Способы получения no
- •Химические свойства оксида азота II – no
- •Оксид азота (I) − n2o
- •Зависимость растворимости некоторых газов от их природы и температуры
- •Способы получения n2o
- •Химические свойства n2o
- •Содержание
Оксид азота (I) − n2o
Оксид азота (I), оксид диазота, закись азота, веселящий газ. При – 88,6ОC сжижается в бесцветную жидкость, которая при – 90,9ОC отвердевает, давая белое вещество. В воде N2O растворяется значительно лучше, чем гелий, водород, азот, кислород, оксид азота II – NO и оксид углерода – СО. Наоборот растворимость оксида азота (I) немного меньше растворимости углекислого газа и значительно меньше растворимости сероводорода. Это видно из приведённой ниже таблицы.
Зависимость растворимости некоторых газов от их природы и температуры
Газ |
He |
H2 |
N2 |
O2 |
CO |
NO |
N2O |
CO2 |
H2S |
0OC |
0,978 |
2,15 |
2,35 |
4,89 |
- |
7,38 |
130 |
- |
467 |
20OC |
0,861 |
1,82 |
1,54 |
3,10 |
2,32 |
4,71 |
62,9 |
87,2 |
258 |
80OC |
- |
1,60 |
0,96 |
1,78 |
1,43 |
2,70 |
54,4 |
35,9 |
97,1 |
При охлаждении из водного раствора кристаллизуется клатрат 8 N2O • 46 H2O.Лучше чем в воде N2O растворим в низших спиртах и низших кетонах.
Запах у N2O слабый, приятный. Вкус сладковатый. При вдыхании смеси воздуха с N2O наступает состояние близкое к опьянению: человек без видимых причин хохочет, размахивает руками, потом через 10-15 минут засыпает. Это свойство N2O используется для проведения операций у беременных женщин, так как другие средства для наркоза могут вызвать уродства у будущего ребенка.
Электронное и пространственное строение N2O представлено на стр.26. Его строение очень напоминает строение углеводорода аллена – алкадиена с кумулированными двойными связями.
Способы получения n2o
При взаимодействии щелочных и ряда щелочноземельных металлов с концентрированной азотной кислотой выделяется N2O:
8
Na + 10 HNO3(конц.)
![]() 8 NaNO3
+ N2O↑
+ 5 H2O
8 NaNO3
+ N2O↑
+ 5 H2O
4 Ba + 10 HNO3(конц.) 4 Ba(NO3)2 + N2O↑ + 5 H2O
В лаборатории N2O обычно получают путём термического разложения нитрата аммония:
NH4NO3 N2O↑ + 2 H2O↑ (пар)
Имеется много модификаций этой реакции: смешиваются и греются две соли, в одной из которых есть ион аммония, а в другой нитрат-ион (230 ‹ t ‹ 300ОC)
NH4Cl
+ KNO3
![]() N2O↑
+ 2 H2O
+ KCl
N2O↑
+ 2 H2O
+ KCl
(NH4)2SO4 + Ba(NO3)2 2 N2O↑ + 4 H2O + BaSO4
(NH4)3PO4 + Al(NO3)3 3N2O↑ + 6H2O + AlPO4
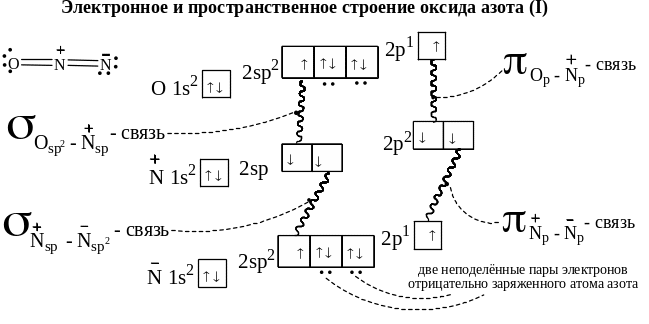
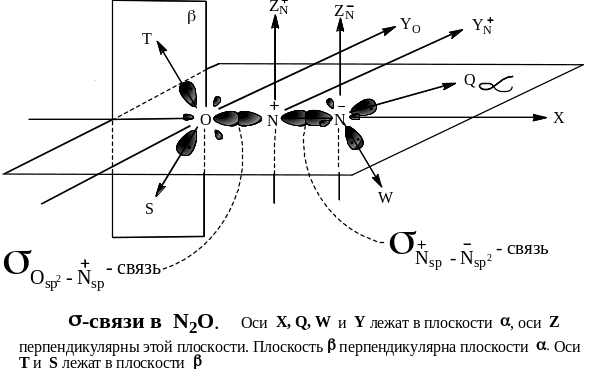
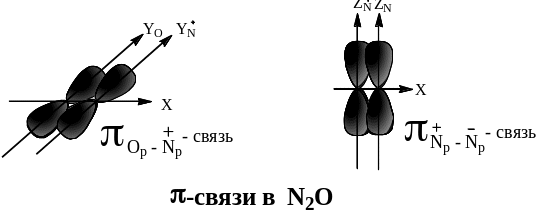
Химические свойства n2o
Как несолеобразующий оксид N2O не реагирует со щелочами и кислотами с образованием солей, но может окисляться кислотами – окислителями при нагревании:
N2O + H2SO4 → 2 NO↑ + SO2↑ + H2O
N2O может окисляться также сильными окислителями в кислой среде:
5 N2O + 2 KMnO4 + 3 H2SO4 → 10 NO↑ + 2 MnSO4 + K2SO4 + 3 H2O
Оксид азота I – N2O по отношению ко многим веществам может быть окислителем. Все простые вещества, которые горят на воздухе, легко сгорают и в N2O:
N2O + H2 → N2 + H2O 2 N2O + C(кокс или графит) → CO2 + 2 N2
2 N2O + S → SO2 + 2 N2 N2O + Ca(так же Mg, Sr, Ba) → CaO + N2
Иногда окисление N2O идёт не до высших степеней окисляемого атома:
N2O + 2 Cu → Cu2O(а не до CuO) + N2 6 N2O + P4 (белый) → P4O6 (а не до P4O10) + 6 N2
Сложные вещества также сгорают в N2O:
3 N2O + 2 NH3 → 4 N2 + 3 H2O 15 N2O + 2 NH3 − CH2 − CH3 → 16 N2 + 4 CO2 + 7 H2O
CH3 − SH + 6 N2O → SO2 + CO2 + 2 H2O + 6 N2
