
- •Лекция № 1 Аналитическая химия: предмет, цель и задачи, основные понятия, принципы.
- •1) Неионизированные
- •2) Ионные ассоциаты:
- •Лекции № 2 Гетерогенные процессы в аналитической химии. Качественный химический анализ катионов по группам.
- •Аналитические классификации катионов по группам.
- •Сероводородная (сульфидная) классификация катионов по группам.
- •VIII. Аммиачно-фосфатная классификация катионов по группам.
- •1) Анализ катионов I и II аналитических групп.
- •1. Схема анализа катионов I группы.
- •2. Схема анализа катионов II группы.
- •2) Анализ катионов III аналитической группы.
- •3. Схема анализа катионов III группы.
- •3) Анализ катионов IV аналитической группы.
- •4. Схема анализа катионов IV группы.
- •4) Анализ катионов V аналитической группы.
- •5. Схема анализа катионов V группы.
- •5) Анализ катионов VI аналитической группы.
- •6. Схема анализа катионов VI группы.
- •6) Анализ смеси катионов I, II, III, IV, V, VI аналитических групп.
- •1. К схеме 1.
- •2. К схеме 2.
- •3. К схеме 3.
- •4. К схеме 4.
- •5. К схеме 5.
- •6. К схеме 6.
6. К схеме 6.
Cu2+: 1) Раствор аммиака осаждает сначала из растворов солей меди (II) осадок основных солей меди голубовато – зеленого цвета, которой растворим в избытке реактива с образованием тетраамминмедб (II) – иона интенсивно – синего цвета:
2CuSO4 + 2NH3 + 2H2O → (CuOH)2SO4 (т) + (NH4)SO4
(CuOH)2SO4 + (NH4)SO4 + 6NH3 → 2[Cu(NH3)4]2+ + 2SO42- + 2H2O
Тетрааммин медь (II) – ион разрушается под действием кислот, вследствие чего синяя окраска раствора переходит в голубую:
[Cu(NH3)4]2+ + 4H+ → Cu2+ + 4NH4+
2) Гексацианоферрат (II) калия при взаимодействии с солями меди образует красно-бурый осадок гексацианоферрата меди, не растворимый в разбавленных кислотах:
2CuSO4 + K4[Fe(CN)6] → Cu2[Fe(CN)6] (т) + 2K2SO4
В избытке раствора аммиака осадок растворяется, переходя в гидроксид тетраамминмеди (II):
Cu2[Fe(CN)6] + 12NH3 + 4H2O → (NH4)4[Fe(CN6)] + 2[Cu(NH3)4](OH)2
Реакцию используют в качестве дробной, осаждая предварительно мешающий Fe3+ раствором аммиака в виде Fe(OH)3. Образовавшийся аммиакат меди синего цвета при добавлении реактива переходит в гексацианоферрат меди (II) красно-бурого цвета.
Hg2+: 1) йодид калия образует ярко-красный осадок HgI2, растворимый в избытке реактива с образованием бесцветного комплексного тетрайодортуть (II) – иона:
Hg2+ + 2I- → HgI2 (т)
HgI2 + 2KI → K2[HgI4]
Реакция проходит в слабокислой среде. Проведению реакции мешает Ag+, Pb2+.
Реакция с йодидами позволяет обнаружить Hg2+ в присутствии всех катионов капельным путем: на бумаге образуется красное пятно HgI2, остающееся при размыве реагентом в центре пятна.
2) Восстановители (SnCl2, Cu) восстанавливают Hg2+ до Hg22+, затем до Hg. В растворах или на фильтровальной бумаге при взаимодействии солей ртути с SnCl2 образуется черный осадок металлической ртути:
Sn2+ + 2HgCl2 → Hg2Cl2 (т) + Sn4+
Hg2Cl2 + Sn2+ → 2Hg (т) + Sn4+ + 2Cl-
Если поместить на медную пластину каплю раствора соли ртути (II), то на пластинке через 4-5 мин образуется черное пятно металлической ртути. При потирании пятна появляется блестящий налет амальгамы меди. Проведению реакции мешают Ag+, Bi3+, Hg22+, Sb (III).
Ni2+: Диацетилглиоксим (реактив Чугаева) образует с Ni2+ внутрикомплексное соединение красного цвета:
Ni2+ + 6NH3 → [Ni(NH3)6]2+
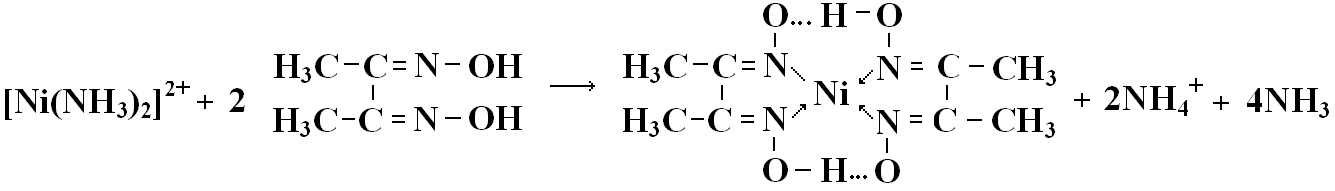
В аммиачной среде раствор окрашивается в розовый цвет, затем выпадает ало-красный осадок диацетилдиоксимата никеля. Если присутствуют мешающие проведению реакции Fe2+ и Cu2+, их предварительно связывают в нерастворимые фосфаты. Реакция очень чувствительна (0,16 мкг). Реакцию можно проводить на фильтровальной бумаге капельным методом и использовать в качестве дробной.
Co2+: тиоцианат аммония в присутствии амилового спирта образует с солями кобальта комплексные соединения сине-голубого цвета – тетратиоцианат кобальта (II) аммония (NH4)2[Co(SCN)4], переходящий в слой амилового спирта:
CoCl2 + 4NH4SCN → (NH4)2[Co(SCN)4] + 2NH4Cl
Чувствительность реакции 0,5 мкг. Проведению реакции мешает присутствие Cu2+, Fe3+, Bi3+. Реакцией с NH4SCN на фильтровальной бумаге Co2+ - ионы можно обнаружить в присутствии всех остальных катионов. Для этого на бумагу наносят каплю раствора тиоцианата, каплю испытуемого раствора, бумагу выдерживают в парах аммиака и подсушивают над пламенем горелки. В присутствии Co2+ периферическая часть пятен приобретает синюю окраску. Иногда для связывания мешающего Fe3+ используют добавление тартратов или фторидов:
6NaF + FeCl3 → Na3[FeF6] + 3NaCl
Cd2+: Под действием сульфидов Cd2+ образует CdS желтого или оранжевого цвета (в кислой среде):
Cd2+ + S2- → CdS (т).
Осадок CdS нерастворим в кислотах. Реакция используется как дробная, предварительно удаляют мешающие катионы обработкой суспензией PbS: появившийся Pb2+ осаждают в виде сульфатов.
