
2. Спектри випромінювання атомів н, Li, He.
Для визначення спектрів випромінювання атомів необхідно знати їх спектральні терми основного і збуджених станів. Знайдемо спектральні терми атома водню для n=1 (основний стан), n = 2,3 (збуджені стани). Для цього визначимо квантові числа атома водню, оскільки атом має один електрон, то s = S, ℓ = L, j = J. При n = 1 квантове число ℓ = L= 0, тоді mℓ = mL= 0, квантове число s = S = 1/2 і квантове число j = J = L±
± S = 1/2. Таким чином основний спектральний терм атома водню такий: 1 2S1/2. При n = 2 квантове число ℓ приймає два значення 0 і 1. Для ℓ = 0 маємо терм 2 2S1/2, а для ℓ = 1 будемо мати два значення квантового числа J, одне J = L + S = 3/2, а друге J = L- S = 1/2, яким відповідають такі спектральні терми 2 2Р1/2 і 2 2Р3/2. Отже, для n = 2 маємо три спектральні терми, обумовлені спін-орбітальною взаємодією, 2 2S1/2, 2 2Р1/2, 2 2Р3/2. При n = 3 квантове число ℓ приймає значення 0, 1, 2 і будемо мати такі спектральні терми: 3 2S1/2, 3 2Р1/2, 3 2Р3/2, 3 2D3/2, 3 2D5/2 Згідно формули (31) енергія електрона атома водню з урахуванням спін-орбітальної взаємодії залежить від квантових чисел n і j, тому спектральні терми з одинаковими квантовими числами j=J мають однакову енергію.
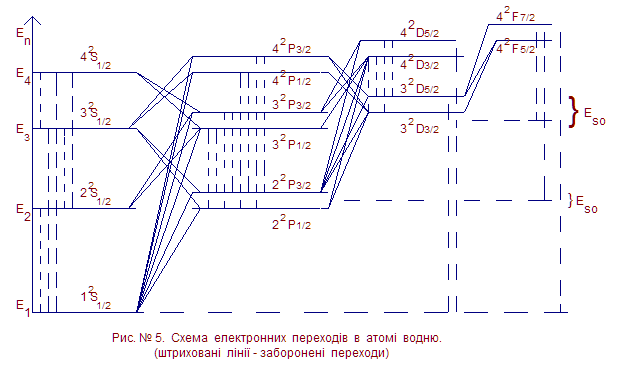
Схема електронних переходів між спектральними термами атома водню показана на Рис. №5. Пунктирними лініями показані заборонені переходи, для них не виконуються правила відбору. З рисунку видно, що головна лінія серії Лаймана λ21 = 2πħс/(Е2 – Е1) розщепляється за рахунок спін-орбітальної взаємодії та релятивістського ефекту на дві лінії: 22Р3/2 – 12S1/2 і 22P1/2 – 12S1/2. Інші спектральні лінії 3Р –2S, 3P—1S, 4P—3S, 4P –
-2S, 4P—1S теж розщепляються на дві лінії. Всі переходи nP—kS, nS—kP, (n > k) утворюють серію дублетів. Переходи nD—kP, nP—kD являються триплетами. Серед всіх переходів найбільш яскравим (інтенсивним) являється перехід 2Р—1S. Це обумовлено розподілом атомів по станах за законом Больцмана:
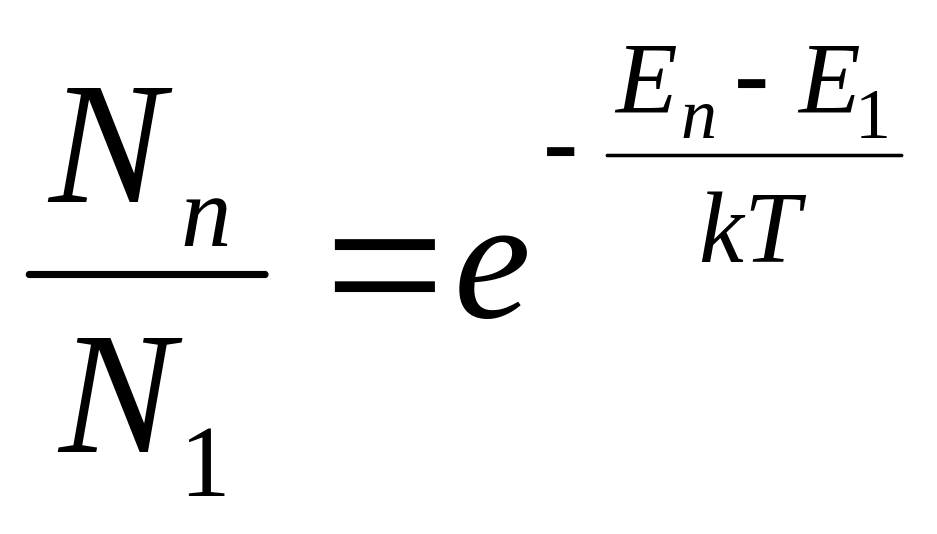 .
.
Найбільше збуджених атомів N2 буде в стані Е2 (n= 2). З ростом n кількість збуджених атомів зменшується, тому інтенсивність ліній випромінювання буде зменшуватися.
Розглянемо спектр випромінювання атома літія (1s22s1). Спектр атома Li визначається переходами електрона 2s1, оскільки 1s2 електрони більш сильно зв`язані з ядром і при не досить великих енергіях збудження не змінюють свою енергію. Тому електронні конфігурації збуджених атомів Li виглядають так: 1s22s02p1, 1s22s02p0 3s1, 1s22s02p03s03p1, 1s22s02p03s03p03d1 і так далі. На відміну від атома водню в атомі Li енергія електрона 2s1 залежить не тільки від n, j, але і від квантового числа ℓ, терми 32S1/2 і 32P1/2 мають різні енергії. Це можна пояснити не Кулонівським потенціалом електричного поля, в якому знаходиться зовнішній електрон лужного атома. Лужний атом - фізична система, яка складається з багатьох тіл (літій- це ядро і три електрона, натрій – це ядро і одинадцять електронів, і т. д.). У всіх лужних атомах зовнішній s-електрон знаходиться в стаціонарному стані з квантовим числом n на одиницю більшим, ніж найближчі до нього електрони (літій: - 1s22s1, натрій: …2р63s1, калій: …3р63d04s1, і т.д.), тому цей електрон знаходиться на деякій відстані від інших електронів атома. Це дає підставу вважати ядро атома і всі електрони (крім s1 електрона) одним зарядженим тілом (остов), a s1 електрон - другим зарядженим тілом (див. рис.№ 6.). Відстань між s1 електроном і остовом порівняна з розміром самого остова, тому потенціал електричного поля остова, в якому знаходиться s1 електрон, не задовольняє формулі Кулона (U(r) = - Ze2/4πεor).

Схема електронних переходів в атомі Li показана на Рис. № 6. Спектр випромінювання атома літію (та інших лужних металів) складається з дублетів. Електронні переходи P-S утворюють головну серію ліній спектра, до цієї серії належить дуже яскравий, інтенсивний дублет ліній 22P1/2—22S1/2 і 22P3/2--22S1/2 по якому визначають атом. Нагадаємо, що довжина хвилі випромінювання залежить від Z2 – номера атома в таблиці елементів. Переходи nS—kP утворюють різку серію з чіткими лініями випромінювання, а переходи nD—kP і nP—kD (n > k) – дифузну серію. Лінії випромінювання дифузної серії слабко виражені, оскільки з ростом енергії зменшується заселеність енергетичного рівня (закон Больцмана Nn=N1e-En/kT, де E1= 0).
Розглянемо спектр випромінювання атома гелію (1s2). При не досить великих енергіях збудження один із електронів 1s2 переходе в стани з більшою енергією. Орієнтація спінових моментів електрона в збудженому стані з одинаковою ймовірністю може бути як паралельною так и антипаралельною. Електронні конфігурації, спектральні терми збуджених станів атома гелію та електронні переходи наведені в таблиці № 3.
Таблиця № 3.
Електронна конфігурація атома в збу- дженому стані. |
Квантові числа атома Не
|
Спектральні терми Не в збудженому стані.
|
Електронні переходи
|
|
триплети
|
синглети
|
|||
|
S = 1, L = 0, J = 1 |
2 3S1 |
33P0 - 2 3S1 33P1 - 2 3S1 33P2 - 2 3S1
33S1 - 23P0 33S1 - 23P1 33S1 - 23P2 |
21P1 - 2 1S0
31S0 - 21P1 |
|
S = 0, L = 0, J = 0 |
2 1S0 |
||
|
S = 1, L = 1, J = 2, 1, 0. |
2 3P2, 2 3P1, 2 3P0 |
||
|
S = 0, L = 1, J = 1 |
2 1P1 |
||
|
S = 1, L = 0, J = 1 |
3 3S1 |
||
|
S = 0, L = 0, J = 0 |
3 1S0 |
||
Як видно з таблиці, спектр випромінювання атома гелію представляє серію триплетів і синглетів. Вчені деякий час не могли пояснити такий спектр випромінювання гелія і вважали, що гелій - це суміш газів, один з яких дає триплети, а другий - синглети. Тільки після відкриття у електрона спінового момента і формулювання принципа Паулі стало можливим пояснити спектр випромінювання атома гелія.
