
- •Работа 1 определение чисел переноса в ионных полупроводниках
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 2 определение константы диссоциации слабого электролита
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 3 определение растворимости труднорастворимого соединения
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 4 определение стандартного окислительно-восстановительного потенциала
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 5 перенапряжение разряда ионов водорода
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 6 потенциометрическое титрование
- •Экспериментальная часть
Контрольные вопросы
Напишите уравнение кривой поляризации при малых перенапряжениях.
Какие факторы влияют на поляризацию электролиза?
Что такое ток обмена, от каких факторов он зависит?
Каков физический смысл коэффициентов переноса α и β?
Какие теории водородного перенапряжения Вы знаете?
Работа 6 потенциометрическое титрование
Потенциометрический метод анализа основан на изменении величины потенциала электрода в зависимости от физико-химических процессов, протекающих в растворе. Величина потенциала зависит от природы электрода и раствора, находящихся во взаимном контакте, типа химических реакций, температуры и других факторов. Измеряя разность потенциалов электродной пары, можно проследить за ходом химических реакций. Конец реакции определяют по резкому изменению электродного потенциала в эквивалентной точке.
Электродная пара, составляющая гальванический элемент, состоит из индикаторного электрода и электрода сравнения. Электрод, который реагирует на изменение концентрации определяемого иона в растворе, называется индикаторным электродом. Электрод, потенциал которого не изменяется в процессе титрования и служит для определения потенциала индикаторного электрода, называется электродом сравнения.
Индикаторный электрод выбирают в зависимости от типа реакций, лежащих в основе титрования. Потенциал индикаторного электрода должен устанавливаться практически мгновенно в соответствии с концентрацией титруемых ионов.
Индикаторные электроды можно классифицировать в зависимости от типа реакций, лежащих в основе их работы. Потенциометрический анализ позволяет изучать реакции нейтрализации, осаждения, комплексообразования и окисления-восстановления.
При потенциометрическом титровании концентрация (активность) участвующих в реакции веществ изменяется, что влечет за собой изменение потенциала индикаторного электрода, а значит, измеряемой ЭДС гальванического элемента (Е). если построить график в координатах Е – V (где V – область прибавляемого рабочего раствора), то получится кривая титрования с резким изменением потенциала электрода (рисунок 5). Вертикальный участок кривой четко указывает на точку эквивалентности. При малом угле наклона кривой титрования определение точки эквивалентности усложняется. В этом случае пользуются дифференциальной потенциометрической кривой (рисунок 6), которую строят в координатах ΔE/ΔV – V, где ΔE – изменение потенциала электрода между двумя порциями добавленного рабочего раствора; ΔV – порция добавленного рабочего раствора. Точка эквивалентности определяется как точка максимума на дифференциальной кривой титрования.
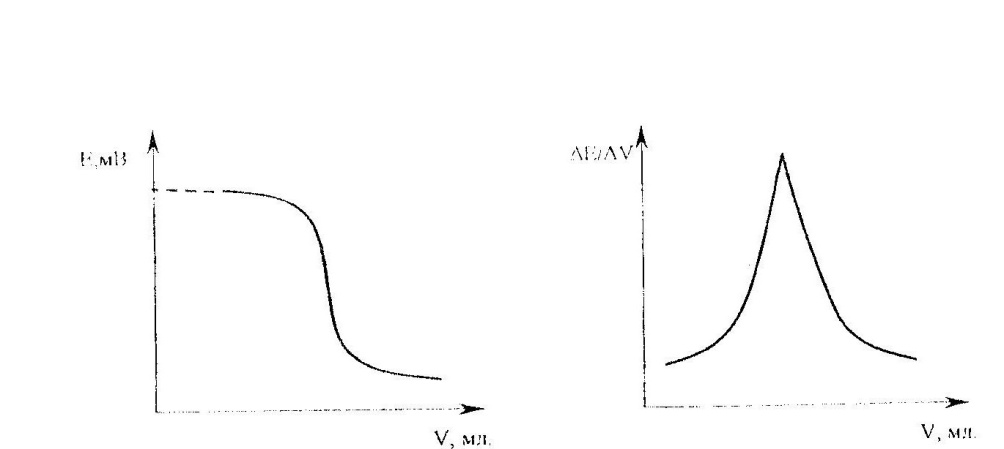
Рис.5.Кривая потенциометрического Рис.6. Дифференциальная кривая
титрования потенциометрического титрования
Потенциометрические кривые титрования сильного основания сильной кислоты аналогичны кривым, представленным на рисунках 5 и 6.
Более сложный вид имеют кривые титрования многоосновных и слабодиссоциирующих кислот и оснований. В качестве примера рассмотрим титрование соли карбоната натрия, образованной слабой двухосновной угольной кислотой и сильным основанием. Кривые титрования (рисунок 7) обнаруживают ступенчатость титрования карбоната натрия соляной кислотой.
При титровании раствора карбоната натрия раствором соляной кислоты протекают следующие реакции:
Na2CO3 + HCl = NaHCO3 + NaCl;
NaHCO3 + HCl = H2CO3 + NaCl.
Как видно из рисунка 7, потенциометрические кривые имеют две точки эквивалентности. Первая соответствуют образованию NaHCO3, вторая – образованию H2CO3.
В исходном растворе карбоната натрия рН определяют по формуле
pH = 7 + pK2 + lg Cсоли , (6.1)
где К2- константа диссоциации угольной кислоты для второй ступени диссоциации, равная 5,61*10-11.
В первой точке эквивалентности, когда Na2CO3 полностью оттитрована до NaHCO3 , рН раствора определяют по формуле:
pH
=
 , (6.2)
, (6.2)
где К1 – константа диссоциации угольной кислоты для первой ступени диссоциации, равна 4,31*10-7.
Во второй точки эквивалентности, когда карбонат натрия полностью оттитрован до свободной угольной кислоты и хлорида натрия, рН раствора находят по формуле:
pH = pK1 - lg CH2CO3. (6.3)
После второй эквивалентной точки рН раствора определяется избытком добавленной соляной кислоты.
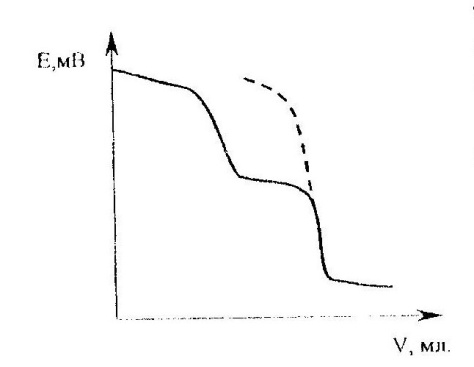
Рис.7. Кривая потенциометрического титрования
