
- •Работа 1 определение чисел переноса в ионных полупроводниках
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 2 определение константы диссоциации слабого электролита
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 3 определение растворимости труднорастворимого соединения
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 4 определение стандартного окислительно-восстановительного потенциала
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 5 перенапряжение разряда ионов водорода
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 6 потенциометрическое титрование
- •Экспериментальная часть
Контрольные вопросы
Что такое кажущиеся и истинные числа переноса?
Какие способы установления чисел переноса вы знаете?
Какие факторы влияют на числа переноса?
Напишите уравнение связи чисел переноса ионов с их подвижностями?
Работа 2 определение константы диссоциации слабого электролита
Способность раствора проводить электрический ток обусловлена движением ионов, которые образуются вследствие электрической диссоциации вещества. Для характеристики электропроводности электролита используют величины удельной χ и мольной λ электропроводности, которые могут быть представлены выражениями:
χ=
1/ ρ; ∑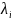 =
χ/∑
=
χ/∑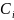 ,
(2.1)
,
(2.1)
где ρ – удельное сопротивление, Ом*м;
χ – удельная электропроводность, Ом-1*м-1;
с – концентрация, моль/л;
λ – ионная электропроводность, Ом-1*м2*моль-1.
Удельная электропроводность численно равна току (А), проходящему через слой раствора с поперечным сечением 1м2 и протяженностью 1 м под действием градиента потенциала 1 В/м.
На практике во многих случаях удобнее пользоваться мольной электропроводностью, которая равна проводимости 1м3 раствора, содержащего 1 моль электролита.
Мольная
проводимость зависит от концентрации
раствора. С уменьшением концентрации
она увеличивается и достигает предельного
значения, которое называется
электропроводностью при бесконечном
разбавлении и обозначается
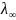 или
или
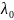 .
.
Для слабых электролитов зависимость электропроводности от концентрации раствора определяется изменением степени диссоциации
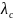 =
αсЧλ0,
(2.2)
=
αсЧλ0,
(2.2)
где αс – степень диссоциации при концентрации электролита С;
λс – мольная электропроводность при концентрации электролита равной С.
Мольная электропроводность может быть выражена и через подвижности ионов
λс = αсЧ (v++v-), (2.3)
где v+ и v- - подвижности катиона и аниона соответственно; м2/моль*Ом.
Подвижности ионов определяются произведением их абсолютной скорости движения на постоянную Фарадея:
v+ = v0 + ЧF; v-= v0 – ЧF. (2.4)
мольная электропроводность сильных электролитов до концентраций не выше 0,02 М описывается уравнением Кольрауша, которое позднее теоретически было обосновано Онзагером:
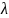 с
= λ0
- α√с. (2.5)
с
= λ0
- α√с. (2.5)
Постоянная α зависит от природы растворителя, температуры и валентного типа электролита. Эквивалентная электропроводность сильного электролита может быть выражена через подвижности ионов
λс
=
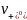 +
+
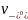 . (2.6)
. (2.6)
Измерение электропроводности растворов слабых электролитов дает возможность определить константу электролитической диссоциации, связанную со степенью диссоциации уравнением
Kd
=
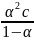 . (2.7)
. (2.7)
Подставив значения степени диссоциации αс = λс/λ0 в уравнение (2.7), найдем
Kd
=
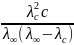 . (2.8)
. (2.8)
Решив уравнение (2.8) относительно произведения λс*с, после некоторых преобразований получим:
λс
*с
= Kd
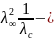 Kd
,
(2.9)
Kd
,
(2.9)
то есть произведение λс *с представляет линейную функцию от 1/ :
λс
*с
= α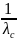 + b,
(2.10)
+ b,
(2.10)
где
α = Kd
*
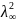 ,
,
b
= Kd
*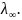
Для слабых электролитов, степень диссоциации которых незначительна, уравнение (2.7) может быть преобразовано, если пренебречь величиной αс в знаменателе, малой в сравнении с единицей:
Kd ≈α2*с, (2.11)
заменив теперь степень диссоциации отношением электропроводностей, получим:
Kd
=
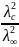 *с.
(2.12)
*с.
(2.12)
После логарифмирования уравнения (2.12) примет вид:
 lg
λc
= lg
λ∞√Kd
-
lg
λc
= lg
λ∞√Kd
-
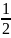 lg
c.
(2.13)
lg
c.
(2.13)
Если величина λ0 , то, строя график в координатах lg λс – lg c, можно рассчитать Kd слабого электролита.
