
- •Аналитическая химия
- •Критерий оценки письменного задания
- •Раздел I. Качественный анализ
- •Тема 1.1 Классификация катионов и анионов. Первая аналитическая группа катионов
- •Тема 1.2 Вторая аналитическая группа катионов
- •Тема 1.4 Четвертая аналитическая группа катионов
- •Тема 1.5. Анионы. Анализ сухой соли
- •Раздел II. Количественный анализ
- •Тема 2.1 Методы количественного анализа
- •Тема 2.2 Гравиметрический (весовой) метод анализа
- •Тема 2.3 Объемный метод анализа. Метод нейтрализации. Теория индикаторов
- •Тема 2.4 Метод окисления – восстановления
- •Тема 2.5 Методы осаждения и комплексонообразования
- •Тема 2.6 Физико-химические методы анализа
Тема 2.5 Методы осаждения и комплексонообразования
Лабораторная работа №21.
«Приготовление рабочего раствора нитрата серебра и установление нормальной концентрации».
Цель работы: научиться готовить рабочий раствор нитрата серебра и определять его нормальную в растворе.
Оборудование: Реактивы. Нитрат серебра АgN03(к). Хромат калия К2Сг04, 5%-й раствор. Посуда. Колбы мерные (100, 500 мл). Пипетка (20 мл). Пипетка дифференциальная (5 мл). Бюретка (25 мл). Колба коническая (250 – 300 мл). Стаканчик весовой (бюкс). Воронка стеклянная.
Перед выполнением лабораторной работы необходимо проработать материал:
Сущность методов осаждения. Аргентометрия (метод Мора), условия применения метода и его значение в проведении химико-технологического контроля.
Сущность метода комплексонообразования и его значение в осуществлении химико-технологического контроля.
Ход работы
Раствор нитрата серебра готовят по навеске препарата АgN03. Стандартизация раствора АgNO3 основана на титровании аликвоты стандартного раствора хлорида натрия раствором нитрата серебра. В качестве индикатора применяется хромат калия.
Выполнение работы. Рассчитывают массу навески АgNO3, необходимую для приготовления 500 мл 0,01М раствора нитрата серебра.
Навеску препарата АgN03 взвешивают на технических весах и количественно переносят в мерную колбу вместимостью 500 мл, растворяют и доводят до метки дистиллированной водой. Так как концентрация раствора АgN03 изменяется при хранении, ее периодически проверяют по «х.ч.» NаС1 методом отдельных навесок или методом пипетирования.
Готовят 0,01М раствор хлорида натрия (первичный стандарт) путем растворения навески хлорида натрия в мерной колбе вместимостью 100 мл. Аликвоту полученного раствора NaCl пипеткой на 20 мл переносят в колбу для титрования, прибавляют 1 мл 5% – го раствора К2Сг04 и титруют рабочим раствором АgN03, при энергичном перемешивании раствора с осадком.
Титрование заканчивают, когда чисто желтый цвет жидкости со взмученным в ней осадком приобретает грязноватый красно-бурый оттенок.
Содержимое колбы после окончания титрования сливают в специально предназначенный для этого сосуд.
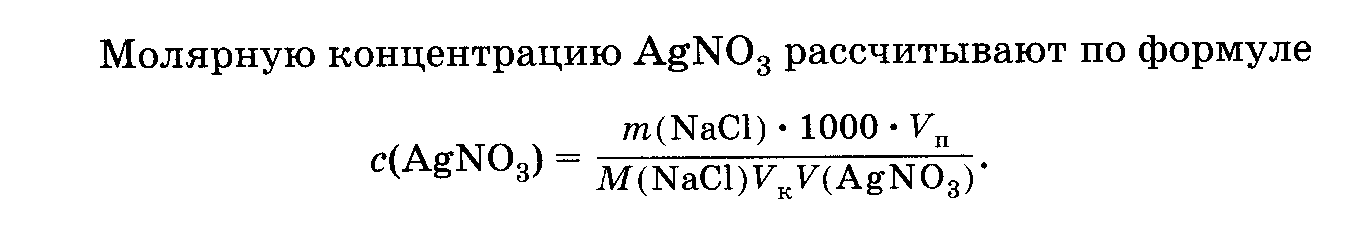
Результаты опыта занесите в таблицу:
Что делали |
Что наблюдали |
Расчеты |
Вывод (уравнения реакций) |
|
|
|
|
Лабораторная работа №22.
«Определение содержания хлорида натрия в растворе»
Цель работы: научиться определять концентрацию хлорида натрия в растворе.
Оборудование: Приборы и реактивы. Мерная колба вместимостью 50 мл. Бюретка вместимостью 10 мл. Пипетка вместимостью 5 мл. Растворы: нитрата серебра (0,1 в., титрованный); хлорида натрия (0,5 н., титрованный); хромата калия (насыщенный).
Перед выполнением лабораторной работы необходимо проработать материал:
Сущность методов осаждения. Аргентометрия (метод Мора), условия применения метода и его значение в проведении химико-технологического контроля.
Сущность метода комплексонообразования и его значение в осуществлении химико-технологического контроля.
Ход работы
Концентрацию растворов некоторых солей можно определить, используя реакции обмена, протекающие с образованием осадков малорастворимых веществ в процессе титрования. Например, для количественного определения хлоридов (или бромидов) металлов можно применить реакцию образования осадка галогенида серебра.
Раствор галогенида титруют раствором нитрата серебра, концентрация которого известна. Для определения конца реакции к раствору галогенида добавляют в качестве индикатора каплю насыщенного раствора хромата калия К2Сг04. Хромат калия с нитратом серебра дает малорастворимую соль Аg2Сг04 темно-красного цвета. Но растворимость хромата серебра значительно больше, чем хлорида серебра. Поэтому хромат серебра начинает выпадать в осадок только после практически полного осаждения ионов хлора. Внешне это проявляется в начинающемся побурении ранее белого осадка, что и служит признаком конца реакции между хлоридом натрия и нитратом серебра.
Выполнение работы. В мерную колбочку вместимостью 50 мл поместите некоторое количество раствора хлорида натрия. Довести объем раствора хлорида натрия до метки, прибавляя к нему из промывалки дистиллированную воду. Воду прибавлять отдельными порциями, каждый раз перемешивая раствор круговыми движениями колбы. Последние капли воды добавлять пипеткой до тех пор, пока нижний уровень мениска жидкости не совпадет с меткой на шейке колбы. После этого плотно закрыть колбу пробкой и хорошо перемешать раствор, перевертывая колбу.
Бюретку вместимостью 10 мл промыть небольшим объемом титрованного 0,1 н. раствора нитрата серебра. Укрепить бюретку в штативе и через воронку налить в нее тот же раствор нитрата серебра несколько выше нулевого деления. (Кончик бюретки также должен быть заполнен.) Выпуская избыток раствора через нижний конец бюретки, довести уровень жидкости в бюретке до нуля.
В коническую колбочку емкостью 50 мл сухой пипеткой внести 5 мл приготовленного раствора хлорида натрия и налить из промывалки приблизительно такой же объем воды. Туда же добавить одну каплю насыщенного раствора индикатора – хромата калия. Провести ориентировочное титрование. Для этого в колбочку с раствором хлорида натрия добавлять из бюретки небольшими порциями (по 0,5 мл) раствор нитрата серебра. Раствор при этом нужно все время перемешивать круговыми движениями колбочки. Необходимо уловить момент, когда чисто-желтый цвет жидкости с осадком перейдет в буроватый. В этот момент нужно прекратить титрование и определить объем израсходованного раствора нитрата серебра.
Повторить титрование еще три раза, но более точно, добавляя последние порции раствора нитрата серебра по каплям. Перед каждым титрованием колбочку для раствора хлорида натрия необходимо тщательно вымыть и сполоснуть дистиллированной водой, а уровень раствора нитрата серебра довести до нуля.
Выразите массу нитрата серебра из формулы в предыдущей 21 лабораторной работе.
Результаты опыта занесите в таблицу:
Что делали |
Что наблюдали |
Расчеты |
Вывод (уравнения реакций) |
|
|
|
|
