
3.2 Температура
С увеличением температуры увеличивается скорость кристаллизации коагулянта. Увеличивается интенсивность броуновского движения, а, следовательно, и вероятность столкновения частиц возрастает, возрастает скорость коагуляции и уменьшается продолжительность инкубационного периода.
При невысоких температурах образуются мелкие медленно оседающие хлопья, увеличивается необходимое количество коагулянта, эффективность очистки падает.
Электронно-микроскопические исследования показали: при температуре (80–90)°С частицы Al(OH)3 сразу же образуют мелкокристаллический осадок, при температуре 20°C – процесс заканчивается через сутки.
3.3 Перемешивание
Перемешивание приводит к возрастанию вероятности столкновения частиц, повышается скорость кристаллизации коагулянта и уменьшается продолжительность инкубационного периода.
Однако при значительном возрастании скорости перемешивания наблюдается обратный процесс. Наблюдается разрушение образовавшихся крупных хлопьевидных агрегатов из аморфных и мелкокристаллических частиц.
Таким образом, перемешивание оказывает влияние на всех стадиях коагуляционной очисти СВ.
3.4 РН раствора
Из уравнения гидролиза видно, что с увеличением степени гидролиза рН раствора падает. Следовательно, для того, чтобы сдвинуть равновесие вправо, нужно увеличивать рН раствора.
Поэтому для полного и быстрого протекания гидролиза необходимо подщелачивать очищаемую воду перед введением коагулянта для связывания выделяющихся при гидролизе Н+- ионов.
Подщелачивающее действие могут выполнять гидрокарбонат-ионы НСО3-, присутствующие в воде, или специальные реагенты – известковое молоко Са(ОН)2, кальцинированная или каустическая сода.
Растворенные в воде примеси
Процесс коагуляции определяется степенью гидролиза коагулянта, которая, в свою очередь зависит от солевого состава сточной воды.
Протекание коагуляции определяет анионный состав растворенных в воде солей:
- если в сточной воде имеется одноимённый с коагулянтом анион, это приводит к ускорению процесса кристаллизации, поскольку уменьшается инкубационный период;
- если в очищаемой воде не содержится одноимённый с коагулянтом анион, то скорость коагуляции уменьшается;
Например, если в сточной воде содержится анион Cl- (коагулянт Al2(SO4)3), то образуется большое количество мелких хлопьев, снижается устойчивость коллоидных частиц.
Органические вещества также влияют на протекание процесса коагуляции:
небольшое их количество в сточной воде благоприятно сказывается на процессе коагуляции (ускоряется процесс старения Al(OH)3);
большие количества органических веществ снижают интенсивность коагуляции: эти вещества адсорбируется на растущих кристаллах коагулянта, образуя плёнки, что тормозит рост кристаллов.
Поверхностно-активные вещества (ПАВ) оказывают отрицательное влияние на протекание коагуляционных процессов.
(ПАВ – это вещества, снижающие поверхностное натяжение жидкости, они способны адсорбироваться на поверхности раздела фаз; состоят из углеводордного радикала до C20 и полярной группы - -ОН, -СООН, -NH2, SО3).
При содержании в воде ПАВ снижается вероятность образования зародышей новой фазы и способность их роста, что обуславливает повышение дисперсности и ухудшает эффект очистки.
Концентрация коагулянта
Скорость коагуляции зависит от числа коллоидных частиц в сточной воде и степени насыщения (дозы коагулянта).
Если считать, что кристаллизация коагулянта, добавленного в сточную воду, происходит только на коллоидных частицах, то процесс кристаллизации может быть описан следующим дифференциальным уравнением:
3 _______
d α / d τ = 3 √ ρ no φ (αo- α)2/3 λ,
где αo и α – абсолютное начальное пересыщение и пересыщение к моменту времени τ;
ρ – плотность кристаллов;
no – число коллоидных частиц примеси в единице объёма;
φ – коэффициент формы частиц;
λ – линейная скорость кристаллов при пересыщении.
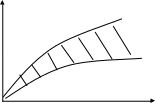
Зависимость скорости коагуляции от концентрации электролита-коагулянта может быть представлена следующим образом (см.рисунок 3.1).
Скорость
коагуляции

ψ=1
Концентрация
Рисунок 3.1 – Зависимость скорости коагуляции
от концентрации электролита - коагулянта
С, мг/дм3
Тонкодисперсная взвесь
Грубодисперсная
С взв., мг/дм3
Рисунок 3.2 – Зависимость скорости коагуляции
от содержания взвешенных веществ
При малых концентрациях электролита эффективность соударения частиц близка к нулю Ψ = 0.
Эффективность соударения Ψ – отношение числа столкновений, окончившихся слипанием, к общему числу столкновений.
При Ψ = 1 наступает быстрая коагуляция, при которой все столкновения частиц заканчиваются образованием агрегатов.
Доза коагулянта зависти и от содержания в воде взвешенных частиц и степени их дисперсности: с увеличением количества примесей доза коагулянта растёт (рис.3.2).
4. Коагулянты и их характеристика
Для очистки сточных вод чаще всего применяются минеральные коагулянты. Это соли алюминия или железа.
