
- •Общая химия Методическое руководство
- •Киров-2009
- •Правила выживания в химической лаборатории
- •Тема: «вводное занятие. Правила работы в химической лаборатории. Количественный анализ. Основы титриметрического (объемного) анализа» значение темы
- •Выполните упражнения (сарс)
- •Уравнение реакции
- •Ход работы
- •Результаты титрования (образец)
- •Основные расчетные формулы, используемые в титриметрическом анализе
- •Тема: «титриметрический (объемный) анализ. Кислотно-основное титрование».
- •Выполните упражнения (сарс)
- •Лабораторная работа. «Определение содержания соды в контрольном препарате».
- •Цель работы:
- •Тема: «количественный анализ. Оксидиметрия. Метод перманганатометрии»
- •Сущность методики
- •Особенности перманганатометрии:
- •Тема: «энергетика химических реакций (химическая термодинамика)» значение темы
- •Выполните упражнения.
- •Оборудование и реактивы
- •Выполнение работы
- •Оформление результатов
- •Тема: «кинетика химических реакций. Химическое равновесие» значение темы
- •Выполните упражнения.
- •Обсуждение результатов
- •Тема: «растворы. Коллигативные свойства разбавленных растворов». Значение темы
- •Выполните упражнения (сарс)
- •Обсуждение полученных результатов
- •Тема: «растворы электролитов. Сильные и слабые электролиты. Ионное произведение воды. Водородный показатель, рН» значение темы
- •Выполните упражнения (сарс)
- •Интервалы перехода окраски кисЛоТно-основных индикаторов
- •Оборудование и реактивы
- •Выводы по опытам 2 и 3.
- •Тема: «буферные растворы». Значение темы:
- •Выполните упражнения (сарс)
- •Обсуждение результатов и выводы
- •Тема «гетерогенные равновесия и процессы. Условия образования и растворения осадков в растворах малорастворимых электролитов» значение темы
- •I. Выполните упражнения (сарс)
- •Условия образования осадка
- •Растворение осадка
- •Тема: « комплексные соединения». Значение темы
- •Выполните упражнения (сарс)
- •Тема: «окислительно-восстановительные процессы». Значение темы
- •Выполните упражнения (сарс)
- •Окисление и восстановление пероксидом водорода
- •Вариант оформления протокола:
- •Цвет раствора
- •Тема: «поверхностные явления. Адсорбция» значение темы.
- •I Выполните упражнения (сарс)
- •Тема: «коллоидные системы»
- •I Выполните упражнения (сарс)
- •Лабораторная работа
- •Опыт 1. Получение золя берлинской лазури
- •Опыт 2. Определение знака заряда золей (гранул) капиллярным методом
- •Обсуждение результатов и выводы к опытам 1 и 2:
- •Тема: «свойства растворов высокомолекулярных соединений» значение темы:
- •I Выполните упражнения (сарс)
- •Лабораторная работа «Свойства растворов высокомолекулярных соединений» цель работы:
- •Тема: “физико-химические методы анализа”
- •Значение темы:
- •Потенциометрия
- •Лабораторная работа «Потенциометрическое титрование»
- •Порядок работы
- •Форма отчета
- •Фотоколориметрия Введение
- •Лабораторная работа
- •Методом фотоэлектроколориметрии»
- •Приготовление стандартной серии растворов.
- •Определение меди в исследуемом растворе.
- •Порядок работы на фотометре кфк – 03 – 01 – «зомз»
- •Подготовка прибора к работе
- •Измерение оптической плотности
- •В выводе укажите:
- •Тема «биогенные элементы» значение темы:
- •Приложение
- •Стандартные ов-потенциалы в водных растворах
- •Константы нестойкости некоторых комплексных ионов
- •Произведения растворимости некоторых малорастворимых электролитов при 250с
- •Константы диссоциации слабых электролитов в водных растворах 298 к
- •Литература.
- •Содержание.
Выводы по опытам 2 и 3.
Сделайте вывод о характере среды в каждой жидкости.
Какова точность каждого метода?
Объясните, в чем преимущества применения
универсального индикатора перед растворами индикаторов;
рН-метра.
Тема: «буферные растворы». Значение темы:
Буферные системы в организме поддерживают кислотно-основное равновесие, то есть постоянное соотношение концентраций Н+-ионов и ОН-ионов, от которого зависит протекание ферментативных биохимических реакций.
Выполните упражнения (сарс)
В воду пробулькивали газообразный SО2. Какое вещество надо добавить к образовавшемуся водному раствору, чтобы получить буферный раствор? Напишите его состав и механизм буферного действия.
Вычислите рН ацетатной буферной системы, полученной смешением 200 мл раствора ацетата натрия с молярной концентрацией 0,4 моль/л и 500 мл уксусной кислоты с концентрацией 0,1 моль/л. Какая буферная емкость: кислотная или основная выше в этом растворе?
Аммиачный буферный раствор получен смешиванием 500 мл 0,2 М раствора NH4ОН и 200 мл 0,4 М раствора NH4Cl.
Какая среда в этом растворе: кислая или щелочная?
Рассчитайте значение рН.
Какая буферная емкость выше – кислотная или основная?
Угольная кислота существует только в растворе за счет растворения углекислого газа. Ее концентрацию можно выразить через парциальное давление углекислого газа (рСО2) и коэффициент растворимости СО2 в жидких средах (S).
[H2CO3] = pCO2 S
Тогда формула для расчета значения рН гидрокарбонатной системы имеет вид:
рН
= рКа + lg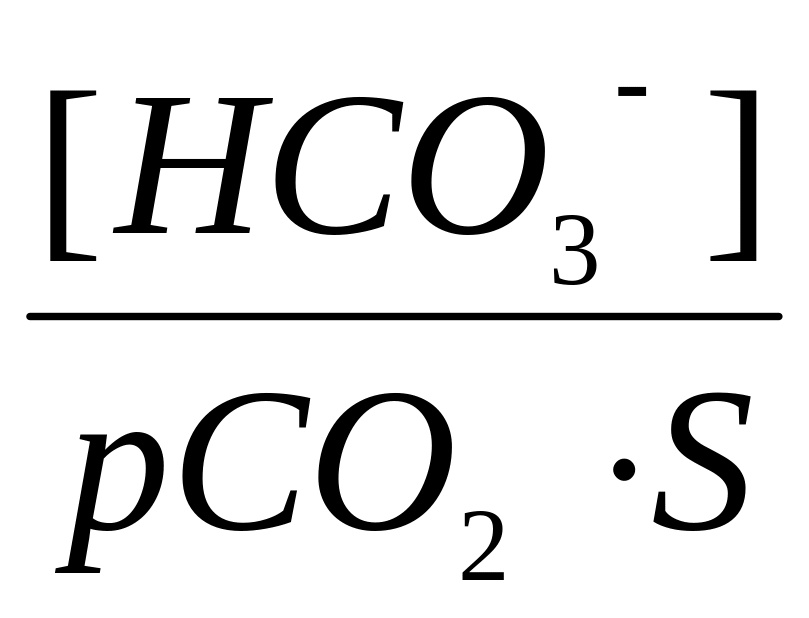 или рН = 6,1 + lg
или рН = 6,1 + lg
Рассчитайте рН гидрокарбонатной буферной системы, если рСО2 = 40 мм.рт.ст, S = 0,03, а концентрация гидрокарбонат-иона равна 2,410-2 моль/л.
В водных растворах -аминокислоты, в зависимости от рН среды, существуют в виде: катиона, нейтральной биполярной молекулы и аниона. На примере аминокислоты глицин (Н2N-СН2-СООН) составьте кислотную и основную буферные системы и запишите механизм их буферного действия.
Рассчитайте величину кислотной буферной емкости, если при добавлении
4 мл 0,5 н раствора Н2SО4 к 50 мл буферного раствора, его рН изменился от
4,2 до 3,5.
Лабораторная работа.
«Приготовление буферных растворов, исследование их свойств и определение буферной емкости»
ЦЕЛЬ РАБОТЫ
Приготовить буферные растворы с определенным значением рН и изучить их свойства.
Рассчитать значение рН приготовленных буферных растворов и сравнить полученные значения с экспериментальными.
Определить буферную емкость по кислоте приготовленных буферных систем.
ПРИБОТЫ И РЕАКТИВЫ
рН-метр, стаканчики для измерения рН – 2 шт., бюретки, пипетки, цилиндр на 25 мл, колбы для приготовления и разбавления растворов. Исходные растворы:
уксусная кислота, С = 0,2 моль/л
натрий ацетат, С = 0,2 моль/л
соляная кислота, С = 0,1 моль/л
Опыт 1. Приготовление буферного раствора. Изучение влияния разбавления на его свойства.
1. Приготовьте три ацетатных буферных раствора объемом по 40 мл с соотношением:
Раствор |
CH3COOH |
CH3CONa |
Vк, мл |
Vc, мл |
1 |
1 |
3 |
|
|
2 |
1 |
1 |
|
|
3 |
3 |
1 |
|
|
Эти растворы в дальнейшем считайте концентрированными.
2. Отмерьте мерной пробиркой или цилиндром 10 мл раствора, вылейте его в стаканчик для измерения рН и прибавьте к нему 20 мл Н2О. Получим разбавленный раствор: Vконц = 30 мл Vразб = 30 мл
3.Измерьте величину рН приготовленных растворов концентрированных и разбавленных (рНэкс.) и результаты занесите в таблицу.
№ буферного раствора |
I |
II |
III |
Дист вода |
|||
Состав буферного раствора Кислота: соль |
1:3 |
1:1 |
3:1 |
||||
конц. |
Разб. |
конц. |
Разб. |
конц. |
разб. |
||
1.рНтеор. |
|
|
|
|
|||
2.рНэксп. |
|
|
|
|
|
|
|
3.Добавление HCl (0,1 н) рНэксп.к |
|
|
|
|
|
|
|
4.Рн |
|
|
|
|
|
|
|
5.Вкисл. |
|
|
|
|
|
|
|
Опыт 2. Исследование влияния добавления сильной кислоты к буферному раствору. Определение буферной емкости по кислоте (Вк).
1.Добавьте:
к 30 мл концентрированного буферного раствора 2 мл HCl;
к 30 мл разбавленного буферного раствора 1 мл HCl.
Измерьте величину рН этих растворов (рНэксп.к), значение запишите в таблицу.
2.Для сравнения возьмите 30 мл дистиллированной воды и измерьте величину рН до и после добавления к ней 1 мл HCl.
