
- •По биоорганической химии
- •По биоорганической химии
- •Способы получения алканов
- •Химические свойства алканов
- •Задачи (алканы)
- •Лабораторная работа № 2
- •Поместите в фарфоровую чашечку 2 мл циклогексена и подожгите. (Опыт выполняется под тягой). Проследите за характером пламени. Наблюдения и выводы запишите в журнал.
- •Задачи (алкены)
- •2. С какими из приведенных соединений реагируют бутен-1 в указанных условиях?
- •H2o, 20c; 7) Br2 / 20c (в темноте); 8) hBr. 9) Na . Напишите уравнения реакций.
- •Лабораторная работа № 3
- •Задачи (алкины)
- •Задачи (диены)
- •Ароматические углеводороды
- •Химические свойства ароматических соединений
- •Лабораторная работа № 4
- •Задачи (ароматические углеводороды)
- •Галогенопроизводные углеводородов
- •Химические свойства алифатических галогенопроизводных
- •Лабораторная работа № 5
- •Задачи (галогенопроизводные)
- •Спирты и фенолы
- •Методы получения спиртов
- •Методы получения фенола
- •Химические свойства спиртов
- •Химические свойства фенола
- •Лабораторная работа № 6
- •Задачи (спирты, фенолы)
- •Альдегиды и кетоны
- •Методы получения альдегидов и кетонов
- •Лабораторная работа № 7
- •Задачи (альдегиды и кетоны)
- •Карбоновые кислоты
- •Методы синтезы кислот
- •Химические свойства карбоновых кислот
- •Лабораторная работа №8
- •Задачи (карбоновые кислоты)
- •Задачи (оксикислоты)
- •Методы получения аминов
- •Химические свойства аминов
- •Химические свойства анилина
- •Задачи (амины)
- •Аминокислоты
- •Методы получения аминокислот
- •Задачи (аминокислоты)
- •Углеводы
- •Химические свойства моноз
- •Лабораторная работа № 9
- •Задачи (углеводы)
Карбоновые кислоты
Карбоновые кислоты содержат карбоксильную группу (-СООН). Кислоты делятся по числу карбоксильных групп на одноосновные и многоосновные, по структуре радикала – на предельные, непредельные, ароматические. Для карбоновых кислот наиболее употребительны тривиальные названия. Сила карбоновых кислот определяется характером радикала, связанного с карбоксильной группой.

Электроноакцепторные заместители увеличивают дефицит электронной плотности на карбонильном углероде, повышают силу кислот. Электронодонорные заместители, напротив, уменьшают силу кислот.
Методы синтезы кислот
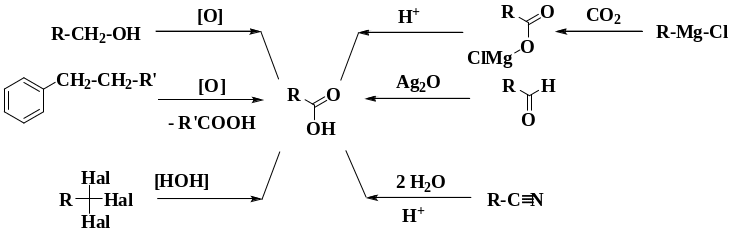
При химических превращениях карбоновых кислот по карбоксильной группе происходит либо замещение водорода гидроксильной группы, либо замещение самой гидроксильной группы с образованием производных карбоновых кислот. Все производные при гидролизе превращаются в карбоновые кислоты. Кроме того, водород в -положении к карбоксильной группе замещается на атом галогена.
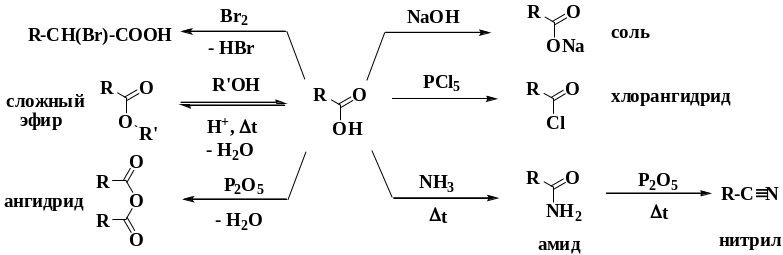
Химические свойства карбоновых кислот
Лабораторная работа №8
Опыт 1. Выделение жирных кислот из мыла и получение кальциевых солей.
Получите у лаборанта 10 мл раствора мыла в воде. Раствор разлейте в две пробирки по 5 мл.
а) В первую пробирку с раствором мыла добавьте 2 мл разбавленной серной кислоты. Происходит обменная реакция и выделяется жирная кислота, которая в воде не растворяется. Поэтому раствор становится мутным.
Нагрейте полученную смесь, а затем охладите. При нагревании жирные кислоты всплывают наверх, а при охлаждении они затвердевают. Наблюдения и выводы запишите в журнал.
б) Во вторую пробирку с раствором прибавьте 2 мл раствора хлористого кальция. Энергично взболтайте. Образуется осадок кальциевых солей высших жирных кислот. Эти соли не растворяются в воде. Наблюдения и выводы запишите в журнал.
Опыт 2. Получение эфиров жирных кислот. Получение этилацетата и изоамилацетата.
а) Уксусноэтиловый эфир (этилацетат). Внесите в пробирку 2 мл этилового спирта, 2 мл ледяной уксусной кислоты и 1 мл концентрированной серной кислоты. Смесь хорошо перемешайте стеклянной палочкой и нагревайте 2 минуты на водяной бане. В результате реакции этерификации образуется уксусноэтиловый эфир, обладающий приятным запахом. Наблюдения и выводы запишите в журнал.
б) Уксусноизоамиловый эфир (изоамилацетат). Внесите в пробирку 2 мл изоамилового спирта (3-метилбутанол-1), 2 мл ледяной уксусной кислоты и 0.5 мл концентрированной серной кислоты. Смесь перемешайте и нагревайте 5 минут на водяной бане. Наблюдения и выводы запишите в журнал.
Содержимое пробирки охладите, и вылейте в другую пробирку с водой. Эфир всплывет наверх. Уксусноизоамиловый эфир имеет запах грушевой эссенции.
Опыт 3. Непредельные кислоты. Свойства олеиновой кислоты.
а) Получение соли олеиновой кислоты.
Налейте в пробирку 1 мл олеиновой кислоты и добавьте 2 мл воды. Обратите внимание на растворимость олеиновой кислоты в воде. Добавьте 2 мл концентрированной щелочи (NaOH); встряхните смесь. Наблюдения и выводы запишите в журнал.
б) Реакция олеиновой кислоты с бромной водой.
К 1 мл олеиновой кислоты прибавьте 1 мл бромной воды и сильно встряхните. Бромная вода обесцвечивается, так как бром присоединяется по двойной связи олеиновой кислоты.
в) Окисление олеиновой кислоты.
К 1 мл олеиновой кислоты прибавьте 2 мл раствора марганцовокислого калия. Энергично перемешайте содержимое пробирки. Олеиновая кислота окисляется до диоксистеариновой кислоты, а марганцовокислый калий восстанавливается с выделением двуокиси марганца. Наблюдения и выводы запишите в журнал.
Опыт 4. Двухосновные кислоты. Получение кислых и средних солей щавелевой и винной кислот.
а) Соли щавелевой кислоты.
К 2 мл 2н. раствора щавелевой кислоты прибавьте 1 мл 2н. раствора едкого калия. Образуется осадок трудно-растворимого щавелевокислого калия. При дальнейшем добавлении щелочи осадок растворяется с образованием средней калиевой соли щавелевой кислоты. Наблюдения и выводы запишите в журнал.
б) Соли винной кислоты.
Налейте в пробирку 2 мл 1н. раствора винной кислоты и прибавьте 1 мл 1н. раствора едкого калия. Выпадает осадок кислой калиевой соли винной кислоты. При дальнейшем добавлении щелочи образуется средняя калиевая соль винной кислоты, которая хорошо растворяется в воде. Наблюдения и выводы запишите в журнал.
