
електрохімічні методи
.pdfМІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ХАРЧОВИХ ТЕХНОЛОГІЙ
АНАЛІТИЧНА ХІМІЯ
ТЕСТИ для оцінювання знань та самопідготовки
з електрохімічних методів аналізу
для студентів напрямів 6.051701 - “Харчові технології та інженерія”, 6.051401 – “Біотехнологія”, 6.040106 – “Екологія, охорона навколишнього середовища та збалансоване природокористування”
денної форми навчання
СХВАЛЕНО на засіданні кафедри аналітичної хімії Протокол № 12
від 26.06.2007 р.
Київ НУХТ 2007
Аналітична хімія: Тести для оцінювання знань та самопідготовки з електрохімічних методів аналізу для студ. напрямів 6.051701 - “Харчові технології та інженерія”, 6.051401 – “Біотехнологія”, 6.040106 – “Екологія,
охорона навколишнього середовища та збалансоване природокористування” ден. форм. навч. / Уклад.: Є.Є.Костенко, В.Д. Ганчук, М.Г.Христіансен та ін. –
К.: НУХТ, 2007. – 16 с.
Рецензент М.Й.Штокало, доктор.хім.наук
Укладачі: Є.Є. Костенко, кандидат хім.наук
В.Д. Ганчук, кандидат техн. наук
М.Г. Христіансен,
В.Г. Дроков, кандидати хім.наук
О.М. Бутенко, кандидат техн. наук
Г.М. Біла, кандидат хім.наук
Відповідальний за випуск Є.Є. Костенко, канд.хім.наук, доц.
Електрохімічні методи аналізу (потенціометрія, вольтамперометрія,
кондуктометрія, електрогравіметрія, кулонометрія) широко використовуються в аналізі харчової продукції і сировини, об′єктів довкілля, лікарських препаратах тощо. Вони внесені до державних стандартів, що стосуються оцінки якості у всіх галузях промисловості. Тому володіння теоретичними і практичними основами електрохімічних методів розкриває перед майбутніми спеціалістами-
харчовиками, екологами, біотехнологами широкий діапазон можливостей при працевлаштуванні.
Тести з електрохімічних методів створені для підвищення ефективності самостійної творчої роботи студентів, що виконується у позанавчальний час.
Тести пов′язані з профілем майбутньої спеціальності і призначені для контролю знань і самостійної роботи з аналітичної хімії для студентів всіх технологічних спеціальностей денної форми навчання. Їх слід використовувати при підготовці та проведенні модульних контролів знань студентів.

Білет № 1
1.У прямій потенціометрії використовують залежність…
1.сили струму від електрохімічного потенціалу індикаторного електроду;
2.потенціалу індикаторного електроду від об'єму титранту в процесі титрування;
3.потенціалу індикаторного електроду від концентрації (активності) речовини за рівнянням Нернста;
4.сили струму від концентрації (активності) визначуваної речовини;
5.потенціалу ІСЕ від концентрації (активності) визначуваного іону.
2.Яку із зазначених пар електродів можна використати в кислотно-основному потенціометричному титруванні?
1.Nа – ІСЕ зі скляною мембраною – хлоридсрібний електрод;
2.скляний мембранний електрод – каломельний електрод;
3.металевий електрод – СВЕ;
4.платиновий електрод – каломельний електрод;
5.хінгідронний електрод – СВЕ.
3.Рівняння Нернста для електроду І роду має вигляд:
1. |
E |
Ag |
+ |
/ Ag ↓ |
= E0 + 0,059× lga |
Ag |
+ |
3. |
E |
AgCl / Ag ↓,Cl− |
= E0 |
- |
R ×T |
× lga |
Cl− |
|
||
n × F |
|
|||||||||||||||||
2. |
|
|
|
|
|
4. |
|
|
|
|
|
|||||||
E = E0 |
- 0,059 × lg a |
F − |
|
|
E |
Hg2Cl2 |
/ 2Hg↓,2Cl − |
= E0 - 0,059 × lg a |
Cl − |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
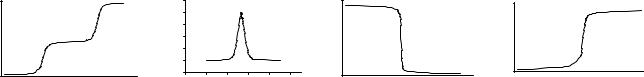
4.Вказати вигляд диференціальної кривої титрування суміші хлориду і йодиду натрію розчином АgNОз.
pH |
pH |
E |
E |
|
V |
|
V |
|
V |
V |
V |
|
|
|
V1,2 |
5. |
Обчислити рН і активність іонів гідрогену в розчині, в якому потенціал |
|||
водневого електроду складає “–0,413 В” (при 25 ˚С). |
|
|||
|
1. 6; 10 −7 |
2. 7; 0,1×10−6 |
3. 3,5; 5×10−4 |
4. 3; 10 −11 . |
6. |
На потенціометричне титрування |
водної витяжки |
лимонного печива |
|
витрачено 10,70 см3 розчину NаОН з С = 0,1000 моль/дм3. Розрахувати масу в мг лимонної кислоти С3Н4ОН(СООН)3 (рК1 = 3,10; рК2= 4,76; рК3 = 6,40, рК4 = 16,0) у водній витяжці.
1. 205 2. 137 3. 68,5 4. 27,4.
7.Питома електропровідність – це…
1.електропровідність 1 см3 розчину електроліту, що містить 1 мольеквівалент електроліту;
2.рухливість іону;
3.величина обернена до опору R розчину;
4.електропровідність розчину, який міститься між електродами площею 1 см² та відстань між якими 1 см.
8. Визначити молярну концентрацію та масову частку ацетатної кислоти в розчині, якщо його питома електропровідність дорівнює 0,75 Ом·см −1 , а при вимірюванні електропровідності стандартних розчинів одержано такі дані:
ТСН3СООН, г/см3 |
0,01002 |
0,05000 |
0,1000 |
|
0,1500 |
0,2000 |
χ, Ом·см −1 |
3,50 |
1,46 |
0,90 |
|
0,64 |
0,47 |
1. 2; 11,80; |
2. 1,21; 7,26; |
3. 0,66; 3,96; |
4. 2,55; 15,00. |
|||
9.Метод вольтамперометрії – це метод, що об’єднує групу електрохімічних методів аналізу, які базуються на:
1.вивченні поляризаційних кривих;
2.вивченні кривих залежності сили струму від молярної концентрації розчину;
3.побудові кривих залежності оптичної густини від довжини хвилі;
4.вимірюванні потенціалу індикаторного електроду.
10.Визначити величину граничного дифузійного струму Cu(ІІ) на 0,1000 М
розчині нітрату натрію, якщо С = 5,0·10-4 М, D = 1,8·10-5 см2·с-1, m = 5,2 мг/с, τ = 2,3 с.
1. 4,09 мкА |
2. 3,9 мкА |
3. 6,0 мкА |
4. 1,7 мкА |
Білет № 2
1.Потенціометрія ґрунтується на...
1.вимірюванні ЕРС гальванічних елементів для визначення концентрації (активності) визначуваних іонів;
2.вимірюванні сили струму, що виникає внаслідок електродного процесу;
3.вимірюванні електрохімічного потенціалу індикаторного електроду відносно електроду порівняння для визначення концентрації іонів в досліджуваному розчині;
4.вимірюванні маси речовини, яка відкладається на індикаторному електроді в процесі електролізу.
2.Яку із зазначених пар електродів можна використати в окисно-відновному титруванні?
1.скляний мембранний електрод – хлоридсрібний електрод;
2.електрод з благородного металу – хлоридсрібний електрод;
3.металевий електрод – каломельний електрод;
4.мембранний ІСЕ – платиновий електрод.
3.Рівняння Нернста для електроду II роду має вигляд:
1. E = constскла + 0,059 × lg aH + |
3. EHg2Cl2 / 2Hg↓,2Cl− = E 0 - 0,059 × lg aCl − |
|||
2. E |
Ag + / Ag ↓ |
= E0 + 0,059× lga |
Ag + |
4. E = -0,059× pH |
|
|
|
||
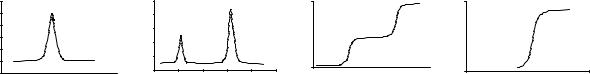
4. Вказати вигляд інтегральної кривої титрування суміші двох слабких кислот: молочної (рК = 3,83) і фторидної (рК = 3,21).
pH |
pH |
pH |
|
pH |
|
V |
|
|
|
|
VNaOH |
VNaOH |
VNaOH |
VNaOH |
5. У стандартних розчинах СdSO 4 |
було виміряно потенціали: |
|
|
|
С Сd2+ , |
10 −1 |
10 −2 |
10 −3 |
10 −4 |
10 −5 |
моль/дм3 |
|
|
|
|
|
Е, мВ |
75,0 |
100 |
122 |
146 |
170 |
За цими даними побудовано градуювальний графік в координатах Е – рСd. Досліджуваний розчин солі кадмію об’ємом 20,00 см3 розбавили водою до 100,00 см3 і виміряли потенціал Сd – ІСЕ в одержаному розчині Ех= 94 мВ. Визначити концентрацію Сd 2+ в досліджуваному розчині (моль/дм3).
1. 7,9×10−2 ; 2. 1,58×10−2 ; 3. 2,2×10−3 ; 4. 1,8×10−2 .
6. Наважку кухонної солі 1,9830 г розчинено у мірній колбі місткістю 500,00 см3. Визначити масову частку (%) NаСІ у солі, якщо при потенціометричному титруванні 50,00 см3 визначуваного розчину стандартним розчином АgNОз з С = 0,1000 моль/дм3 одержано дані:
V(АgNОз), |
19,0 |
19,5 |
19,9 |
20,0 |
20,1 |
20,5 |
21,0 |
см3 |
|
|
|
|
|
|
|
Е, мВ |
570 |
589 |
629 |
704 |
737 |
757 |
775 |
1. 11,70; |
2. 59,00; |
3. 58,50; |
4. 19,83. |
7.В кондуктометричному титруванні застосовуються такі типи реакцій:
1.Реакції кислотно-основного титрування у НЧТ;
2.Реакції осадження у ВЧТ;
3.Реакції окисно-відновного титрування;
4.Реакції комплексоутворення у НЧТ і ВЧТ;
5.Всі типи реакцій.
8.Опір 0,5000 М розчину К2SО4 в комірці з електродами площею 1,35 см3 та відстанню між ними 0,45 см дорівнює 4,86 Ом. Визначити еквівалентну електропровідність розчину.
1. 41,2; 2. 20,6; 3.136,4; 4. 68,2.
9. Як називається метод, в якому використовується ртутний крапельний електрод?
1. |
полярографією; |
3. |
атомна спектроскопія; |
2. |
кулонометрією; |
4. |
амперометричне титрування. |
10. Визначити концентрацію нікелю (мг/см3) в досліджуваному розчині, якщо при його полярографу ванні висота полярографічної хвилі становила 26,5 мм. В стандартному розчині (СNi2+= 2,23·10-3 моль/дм3) висота хвилі склала 31,2 мм.
1. 0,2047 2. 0,1092 3. 0,1571 4. 0,1235
Білет № 3
1.Потенціометричне титрування – це…
1.титриметричний метод, в якому т.е. встановлюють за різкою зміною потенціалу індикаторного електроду;
2.іонометричний метод визначення окисно-відновного потенціалу в розчині;
3.титриметричний метод, в якому т.е. встановлюється за різкою зміною дифузійного струму;
4.застосування рівняння Нернста для знаходження потенціалу в точці еквівалентності.
2.Електродом ІІ роду називають…
1.металевий стрижень, занурений в розчин солі цього металу;
2.металевий стрижень, вкритий шаром малорозчинної сполуки цього металу;
3.металевий стрижень, вкритий шаром малорозчинної сполуки цього металу і занурений у розчин солі, яка містить аніон малорозчинної сполуки;
4.металевий стрижень, вкритий шаром малорозчинної сполуки цього металу і занурений в розчин солі цього металу.
3.Рівняння Нернста для водневого індикаторного електроду має вигляд:
1. |
E = E 0 + 0,059× lgaH + |
3. |
E = constскла + 0,059 × lg aH + |
2. |
E = -0,059 × pH |
4. |
E = 0,059 ×lg aH + |
4. Вказати вигляд диференціальної кривої титрування суміші хлоридів калію і натрію розчином АgNОз.
Ε |
E |
E |
V |
V |
|
V |
|
V |
E
V 
 V
V
5. Обчислити рН розчину, якщо ЕРС елементу |хінгідронний електрод |
НСООNa ||0,1 M KCl, AgCl| Ag,Cl− | при 20 °С складає 0,006 В. |
|
||
1. 7,91; |
2. 10,53; |
3. 6,85; |
4. 7,38. |
6. 20,00 см3 досліджуваного розчину метиламіну СН3NН2 розведено у мірній колбі до 100,00 см3, далі 10,00 см3 цього розчину відтитровано потенціометрично розчином НСl (С = 0,1000 моль/дм3). Побудувати криву титрування і визначити концентрацію вихідного розчину СН 3 NН2 у моль/дм3 за
такими даними:
V(НСl), |
17,0 |
17,5 |
17,8 |
18,0 |
18,2 |
18,5 |
19,0 |
см3 |
|
|
|
|
|
|
|
рН |
9,43 |
9,20 |
8,30 |
6,00 |
3,30 |
2,90 |
2,6 |
1. 0,18; |
2. 0,9; |
3. 1,8; |
4. 0,36. |
7.Кондуктометричний метод аналізу базується на вимірюванні…
1.електропровідності досліджуваних розчинів;
2.сили струму в процесі електролізу;
3.потенціалу одного з електродів, занурених в розчин;
4.опору досліджуваного розчину залежно від концентрації.
8.Знайти площу електродів комірки, якщо відстань між ними дорівнює 0,5 см, а опір 1 М розчину КСl при температурі 20˚С у цій комірці дорівнює 2,5 Ом.
1. 1,959; |
2. 2,400; |
3. 0,50; |
4. 1,00. |
9.Який процес лежить в основі полярографії?
1.процес електролізу, що супроводжується окисленням або відновленням визначуваної речовини на поверхні одного з електродів;
2.процес електродіалізу, що супроводжується відновленням визначуваної речовини на поверхні одного з електродів;
3.процес синтезу, що супроводжується окисленням визначуваної речовини на поверхні одного з електродів;
4.електрохімічна реакція, що відбувається на поверхні катоду чи аноду.
10.При полярографуванні насиченого розчину броміду плюмбуму на амонійноаміачному фоні висота полярографічної хвилі плюмбуму склала 26 мм, а для 0,01000 М розчину в тих самих умовах – 20 мм. Обчислити добуток розчинності броміду плюмбуму.
1. 2,21·10-6 |
2. 1,57·10-6 |
3. 1,70·10-4 |
4. 2,45·10-6 |
Білет № 4
1. Основні вимоги до реакцій, що використовують у потенціометричному
титруванні. |
|
|
|
1. |
реакції проходять повільно; |
3. |
реакції проходять кількісно; |
2. |
реакції проходять швидко; |
4. |
реакції зворотні. |
2.На чому основані потенціометричні методи аналізу?
1.на вимірюванні провідності або опору, які змінюються залежно від вмісту або складу досліджуваної речовини в розчині;
2.на вимірюванні електрорушійних сил гальванічних елементів для визначення активності речовин та вимірювання фізико-хімічних констант;
3.на вимірюванні міри поглинання світлової енергії досліджуваною речовиною.
4.на вимірюванні дифузійного струму.
3.Які електроди називають електродами першого роду?
1.потенціал яких не залежить від активності катіонів металу, з якого виготовлений електрод;
2.потенціал яких залежить від активності катіонів металу, з якого виготовлений електрод;
3.електроди чутливі до аніонів , що утворюють малорозчинні осади з катіонами металу електрода.
4.Які електроди відносяться до електродів порівняння?
1. |
скляний; |
3. |
каломельний; |
2. |
хінгідронний; |
4. |
хлоридсрібний. |
5. Обчислити потенціал срібного електрода, зануреного у насичений розчин
АgI. ДР АgI =8,3·10 −17 . |
|
|
|
1. – 0,729 В; |
2. – 0,9355 В; |
3. 0.9353 В; |
4. 0,729 В. |
6. При потенціометричному титруванні 20,00 см3 розчину молочної кислоти стандартним розчином NаОН (С=0,1200 М) одержано такі дані:
VNaOH, |
0 |
1,0 |
2,0 |
|
3,0 |
3,1 |
3,2 |
|
3,3 |
3,5 |
4,0 |
см3 |
|
|
|
|
|
|
|
|
|
|
|
рН |
3,4 |
4,0 |
5,0 |
|
6,7 |
7,2 |
9,9 |
|
10,3 |
10,9 |
11,3 |
Побудувати |
криві титрування у координатах рН – V і ∆рН/∆V – V. Розрахувати |
||||||||||
титр і масу молочної кислоти в г/дм3. |
3. 0,001728 г/см3; |
4. 0,003456 г/см3. |
|||||||||
1. 1,72 г; |
|
2. 3,44 г; |
|
||||||||
7.На чому ґрунтується кондуктометричний аналіз?
1.на вимірюванні провідності, яка змінюються залежно від вмісту або складу досліджуваної речовини в розчині;
2.на вимірюванні електрорушійних сил гальванічних елементів для визначення активності речо-вин та вимірювання фізико-хімічних констант;
3.на вимірювання міри поглинання світлової енергії досліджуваною речовиною.
4.на вимірюванні опору, який змінюється залежно від вмісту або складу досліджуваної речовини в розчині;
