
- •1. Утворення та типи хімічного зв’язку
- •2. Ковалентний зв'язок. Метод валентних зв’язків
- •3. Донорно-акцепторний механізм утворення ковалентного зв’язку
- •4. Напрямленість ковалентного зв’язку
- •5. Гібридизація атомних електронних орбіталей
- •6. Йонний зв’язок
- •7. Водневий зв’язок
- •8. Металічний зв’язок
- •Запитання для самоконтролю
6. Йонний зв’язок
Утворення і властивості йонного зв'язку. Сполуки з йонним типом зв'язку утворюються в результаті взаємодії елементів, атоми яких значно різняться електронегативністю. Як уже зазначалося, йонний зв'язок виникає за умови, що різниця між значеннями електронегативностей елементів перевищує 1,9. Якщо ж ця різниця менша за 1,9, то зв'язок має ковалентний характер. Наприклад, натрій бурхливо реагує з хлором, внаслідок чого утворюється хлорид натрію, що має йонну кристалічну будову (аесі - «Na = 3,0 - 0,9 = 2,1 > 1,9): Початкові теоретичні уявлення про іонний зв'язок запровадив В. Коссель. Суть його поглядів полягає в таких основних твердженнях: 1) під час взаємодії двох атомів один з них віддає електрон і перетворюється на позитивно заряджений іон (М - Іе~ = М+) — катіон, інший атом приєднує електрон і перетворюється на негативно заряджений іон (А + 1е~ = А') — аніон; 2) іони з протилежними зарядами електростатичне притягуються один до одного й утворюють стійку сполуку з йонним зв'язком. Хлорид натрію NaCl є типовим прикладом йонної сполуки. Такі процеси перетворення атомів на іони виявляються енергетичне вигідними тоді, коли атом, що віддає електрон, має низьку енергію іонізації, а атом, що його приєднує, — велику спорідненість до електрона. У реакціях, внаслідок яких утворюються сполуки з йонним типом зв'язку, атоми намагаються набути найстійкішої електронної конфігурації. Так, одноатомні аніони F~, Cl~, Вг~ та деякі катіони (Na+, K+, Са2+, Ва2+) мають будову зовнішнього електронного шару атомів найближчого інертного газу (ns2np6).
В основу йонного зв'язку покладено переважно електростатичну взаємодію між іонами, тому, на відміну від ковалентного, іонний зв'язок характеризується ненапрямленістю та ненасиченістю. Ненапрямленгсть іонного зв'язку зумовлена тим, що електричне поле кожного іона, який уявно можна розглядати як заряджену сферу, поширюється у просторі в усіх напрямках. Ненасиченгсть іонного зв'язку пов'язана з тим, що в результаті взаємодії двох протилежно заряджених йонів їхні електричні поля компенсуються не повністю, тому можливе притягання цих йонів у інших напрямках (рис. 5.34)
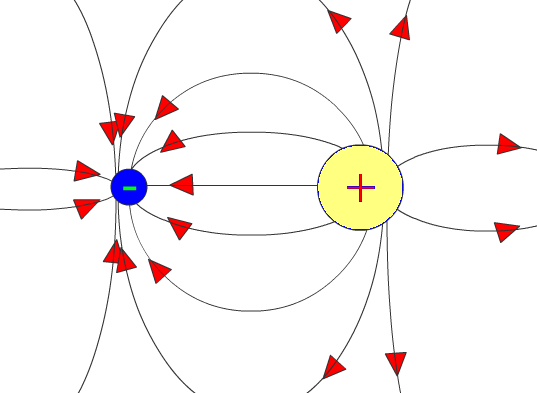
.
Рис.1. Розподіл електронних силових полів двох протилежно заряджених йонів
У результаті кожний йон оточує себе іонами протилежного заряду.
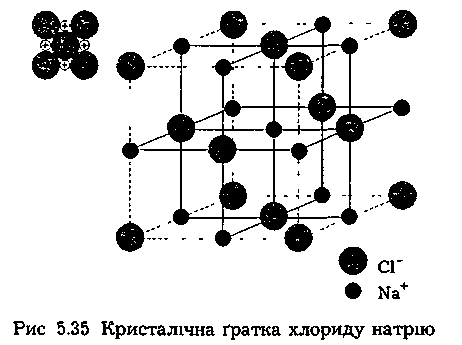
Сполуки
з йонним типом зв'язку у вигляді молекул
не існують ні в твердому стані, в якому
вони мають йонну кристалічну
ґратку,
ні в розчині, де вони дисоціюють на іони
під впливом
полярних
молекул розчинника. Нестійкі молекули
йонних сполук
(NaCl,
LiCl
та
ін.), а також їхні асоціати можна виявити
тільки в
газовому
стані за високих температур.
7. Водневий зв’язок
Крім вандерваальсових сил міжмолекулярної взаємодії між деякими молекулами або певними групами у складних молекулах може виникати водневий зв’язок.
Водневий зв’язок виникає як особливий тип взаємодії між молекулами або функціональними групами у складних молекулах, до складу яких входять атоми водню, ковалентно сполучені з найбільш електронегативними атомами — найчастіше киснем, азотом і фтором. Він має складну природу внаслідок значного внеску електростатичної і певною мірою донорно-акцепторної взаємодії. Подібно до ковалентного зв’язку водневий зв’язок характеризується насиченістю і просторовою напрямленістю.
З урахуванням цього водневий зв’язок утворюється немовби за рахунок побічної валентності атома водню.
Механізм його виникнення можна пояснити так. У сполуках типу Х–Н узагальнена електронна пара зміщена до найбільш електронегативного атома. Позитивно поляризований атом водню можна уявити як частково оголене ядро, що має надзвичайно малий розмір і внаслідок цього — високу напруженість позитивного електричного поля. Це зумовлює його енергійний вплив на електронну оболонку атома Y сусідньої молекули (групи), яка має негативний заряд. Схематично утворення водневого зв’язку можна подати так:
![]() –
–
![]() +
+
![]() –
X
– H
Y
– H
–
X
– H
Y
– H
Водневий зв’язок позначають трьома крапками.
Атом водню зазвичай міцніше зв’язаний з тим із двох атомів, з яким утворює ковалентний зв’язок.
Енергія водневого зв’язку становить 8–40 кДж/моль. За міцністю він перевищує вандерваальсову взаємодію, але здебільшого слабкіший від ковалентного зв’язку.
Водневий зв’язок дуже поширений і відіграє важливу роль у структурі багатьох неорганічних та органічних сполук.
