- •1. Утворення та типи хімічного зв’язку
- •2. Ковалентний зв'язок. Метод валентних зв’язків
- •3. Донорно-акцепторний механізм утворення ковалентного зв’язку
- •4. Напрямленість ковалентного зв’язку
- •5. Гібридизація атомних електронних орбіталей
- •6. Йонний зв’язок
- •7. Водневий зв’язок
- •8. Металічний зв’язок
- •Запитання для самоконтролю
ЛЕКЦІЯ № 4
ХІМІЧНИЙ ЗВ'ЯЗОК І БУДОВА МОЛЕКУЛ
ПЛАН
УТВОРЕННЯ ТА ТИПИ ХІМІЧНОГО ЗВ’ЯЗКУ
КОВАЛЕНТНИЙ ЗВ'ЯЗОК. МЕТОД ВАЛЕНТНИХ ЗВ’ЯЗКІВ
ДОНОРНО-АКЦЕПТОРНИЙ МЕХАНІЗМ УТВОРЕННЯ КОВАЛЕНТНОГО ЗВ’ЯЗКУ
НАПРЯМЛЕНІСТЬ КОВАЛЕНТНОГО ЗВ’ЯЗКУ
ГІБРИДИЗАЦІЯ АТОМНИХ ЕЛЕКТРОННИХ ОРБІТАЛЕЙ
ЙОННИЙ ЗВ’ЯЗОК
ВОДНЕВИЙ ЗВ’ЯЗОК
МЕТАЛІЧНИЙ ЗВ’ЯЗОК
Л І Т Е Р А Т У Р А:
1. Ахметов Н.С. “Общая и неорганическая химия.: Учебник для ВУЗов. – М.: В.школа. – 1981 – 679 с.
2. Басов В.П., Родіонов В.М., Юрченко О.Г. Хімія. Навчальний посібник для самопідготовки до іспитів. К.: Каравела, Львів,: Новий світ – 2000, 2002 – 280с.
3. Глинка Н.Л. Общая химия. Изд. 17,1975, с. 728
4.Рейтер Л.Г., Степаненко О.М., Басов В.П. Теоретичні розділи загальної хімії.: Навчальний посібник.: -К.: Каравела, 2003 - 344 с.
5. Романова Н.В. Загальна та неорганічна хімія. Підручний для студентів вищих навчальних закладів. – К.: Ірпінь. ВТФ “Перун”, 2002 – 480 с.
6. Сегеда А.С. Загальна й неорганічна хімія в тестах, задачах, вправах. Київ: ЦУП, Фітосоціоцентр, 2003 – 592 с.
7. Хомченко И.Г., Сборник задач и упражнений по химии: Учебное пособие для нехимических техникумов.: - М.: В.школа, 1989 – 256 с.
Література: Л.1.(с.41-97), Л.3.(с.111-150), Л.4.(с.64-126), Л.5.(с.72-106), Л.7.(с.39-47), конспект лекції №4.
1. Утворення та типи хімічного зв’язку
Серед індивідуальних хімічних речовин, які поділяють на прості й складні, простих порівняно небагато, причому і серед простих речовин тільки інертні гази складаються
з хімічно незв'язаних один з одним атомів. У всіх інших випадках атоми елементів або міцно сполучені між собою й утворюють молекули, або виникають кристалічні структури з атомів чи іонів, частинки в яких також міцно зв'язані між собою. У всіх хімічних сполуках між атомами елементів, які входять до їхнього складу, виникають хімічні зв'язки.
Залежно від характеру хімічного зв'язку розпізнають ковалентний, іонний та металічний зв'язки. Далі буде розглянуто, коли саме виникає певний тип зв'язку, але щоразу атоми чи іони, які утворюють зв'язок, перебувають на певних відстанях один від одного. Хоча залежно від типів речовин відстані між хімічно зв'язаними частинками називають по-різному (довжина зв'язку - - у ковалентних сполуках, між'ядерні відстані — в іонних та металічних кристалічних речовинах), йдеться про між'ядерні відстані між сполученими атомами. Відстань між хімічно зв'язаними частинками є однією з важливих характеристик хімічного зв'язку. Довжина зв'язку — це відстань між ядрами атомів, які утворюють хімічний зв'язок.
Ця величина залежить від розмірів сполучених частинок (збільшується в міру їх збільшення), а також від способу сполучення (зменшується зі збільшенням кратності зв'язку). Довжину зв'язку в ковалентних сполуках експериментальне визначають кількома методами. Часто довжині зв'язку відповідає сума ковалентних радіусів сполучених атомів, які визначають як половину довжини одинарного ковалентного зв'язку в двохатомній молекулі простої речовини А~А. Подібно й між'ядерні відстані в іонних і металічних кристалах складаються із сум іонних або атомних радіусів. Усі ці величини виражають у пікометрах (1 пм = 10~12 м) або в ангстремах (1 А = 10~10 м). Іншою важливою характеристикою зв'язку є його енергія, або міцність. Утворення зв'язку завжди пов'язане зі зменшенням потенціальної енергії системи. Щоб зв'язок розірвати, треба затратити енергію. Енергія зв'язку настільки велика, що розділити хімічну сполуку на складові атоми простими фізичними методами не вдається.
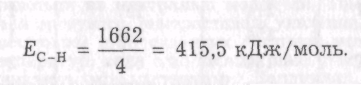 Енергія
зв'язку — це мінімальна енергія, яку
необхідно за тратити для розривання
хімічних зв'язків у 1 моль речовини,
щоб отримати ізольовані атоми.
Енергія
зв'язку — це мінімальна енергія, яку
необхідно за тратити для розривання
хімічних зв'язків у 1 моль речовини,
щоб отримати ізольовані атоми.
Для складних ковалентних сполук типу АВn за енергію зв'язку найчастіше беруть усереднене значення, отримане діленням повної енергії дисоціації на атоми 1 моль речовини на кількість зв'язків у молекулі. Наприклад, під час розщеплення 1 моль метану СН4 на 1 моль атомів вуглецю і 4 моль атомів водню поглинається 1662 кДж/моль енергії, звідки середня енергія зв'язку в молекулі метану дорівнює
Аналогічно взаємодіють іони або атоми, що утворюють іонні й металічні кристалічні речовини. Про визначення цієї енергії йтиметься далі під час розгляду іонного зв'язку. Для рядів подібних речовин більшим між'ядерним відстаням відповідає менша енергія, і навпаки. Енергія зв'язку збільшується в міру зростання кратності зв'язку
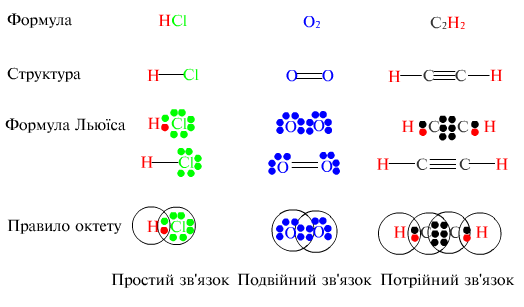
Хімічні сполуки утворюються з атомів елементів відповідно до їхніх валентностей.
Валентність — це здатність атомів одного елемента сполучатися з певним числом атомів інших елементів під час утворення хімічних сполук. Отже, валентність — це міра здатності атомів елементів до утворення хімічних зв'язків. У сучасному розумінні валентність пов'язана з електронною природою утворення хімічного зв'язку. В утворенні зв'язків беруть участь електрони валентних підрівнів взаємозв'язаних атомів. При цьому за рахунок переходів електронів або перерозподілу електронної густини атоми намагаються набути електронної конфігурації Інертних газів, у зовнішньому шарі атомів яких, за винятком гелію, міститься вісім електронів — електронний октет. Відсутність хімічної активності інертних газів засвідчує особливу стійкість їхніх електронних оболонок.
Г. Н.
Льюїс
запровадив простий і зручний спосіб
зображення
валентних
електронів у атомах і врахування їх
поведінки під
час
утворення зв'язків. Цей спосіб ґрунтується
на зображенні
електронів
точками і хрестиками, або льюїсовими
символами.
Такі
льюїсові символи складаються із символів
хімічних елементів, оточених точками
або хрестиками відповідно до числа
валентних електронів. Наприклад, для
елементів другого періоду
льюїсові
символи такі:
Отже, відповідно до уявлень Г. Н. Льюїса
зв'язок виникає
внаслідок
утворення спільних для зв'язуваних
атомів електронних пар, причому внесок
кожного атома умовно зображують
точками
або хрестиками. Ці уявлення згодом
було втілено в
теорію
ковалентного зв'язку.
Кількість
двохелектронних зв'язків, які може
утворити атом
елемента
з іншими атомами, визначається числом
неспарених
електронів
у його нормальному або збудженому
стані. Наприклад, на валентних підрівнях
атома фосфору [Ne]3s23p3
у нормальному стані є електронна пара
на Ss-підрівні
і три неспарені
Зр-електрони:
У разі утворення ковалентного зв'язку між атомами з'являються спільні електронні пари з електронів, які раніше належали окремим атомам. Ці спільні електронні пари сполучених атомів певною мірою належать кожному з них. Потенціальна енергія системи атомів, що взаємодіють, у цьому разі зменшується. Щоб описати стан зв'язуючих електронів у молекулі, потрібно скласти рівняння Шредінгера для відповідної системи електронів та атомних ядер і знайти його розв'язок, що відповідає мінімуму енергії зазначеної системи. Як і для багатоелектронних атомів, квантово-механічний опис будови молекули одержують тільки на основі наближених розв'язків рівняння Шредінгера. Перше наближене розв'язання цього рівняння виконали в 1927 р. німецькі вчені ВТ. Гайтлер та Ф. Лондон для молекули водню. Розглянута ними система спочатку складалася з двох віддалених атомів водню. При цьому електрон кожного атома взаємодіяв тільки з ядром власного атома, а рештою взаємодій — притягуванням електронів до «чужих» ядер, між'ядерним та міжелектронним відштовхуванням — можна було знехтувати. У цьому разі виявилось можливим виразити залежність хвильової функції розглянутої системи від координат і тим самим визначити густину спільної електронної хмари в кожній точці об'єму молекули.
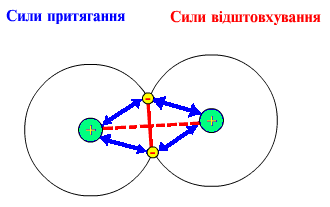
Ф
5.1. Сили притягання ( ç=> ) і відштовхування (----), які діють у молекулі водню
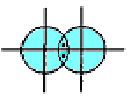
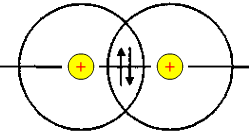
Подане зображення ковалентних зв'язків пов'язане з перекриванням електронних орбіталей у просторі між сполученими атомами. Так, для утворення молекули водню кожний атом водню використовує свою одноелектронну кулясту ls-орбіталь, тому схема утворення зв'язку має такий вигляд:
Д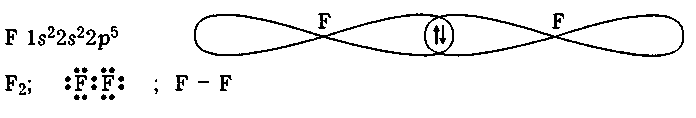 ля
того щоб утворилася молекула фтору F2,
кожному його
атому
потрібно використати одноелектронну
гантелеподібну
2р-орбіталь,
оскільки атом фтору має тільки один
неспарений
електрон
на 2р-підрівні:
Отже, щоб зобразити схему утворення
зв'язку, слід проаналізувати конфігураційні
формули учасників зв'язку, виділити
одноелектронні
орбіталі валентних підрівнів і подати
їх просторове перекривання.
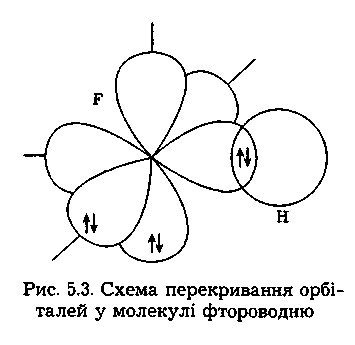
Наприклад, у молекулі фтороводню HF
учасниками
зв'язку є
атоми
водню і фтору. Вони утворюють між собою
ля
того щоб утворилася молекула фтору F2,
кожному його
атому
потрібно використати одноелектронну
гантелеподібну
2р-орбіталь,
оскільки атом фтору має тільки один
неспарений
електрон
на 2р-підрівні:
Отже, щоб зобразити схему утворення
зв'язку, слід проаналізувати конфігураційні
формули учасників зв'язку, виділити
одноелектронні
орбіталі валентних підрівнів і подати
їх просторове перекривання.
Наприклад, у молекулі фтороводню HF
учасниками
зв'язку є
атоми
водню і фтору. Вони утворюють між собою

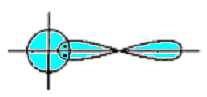
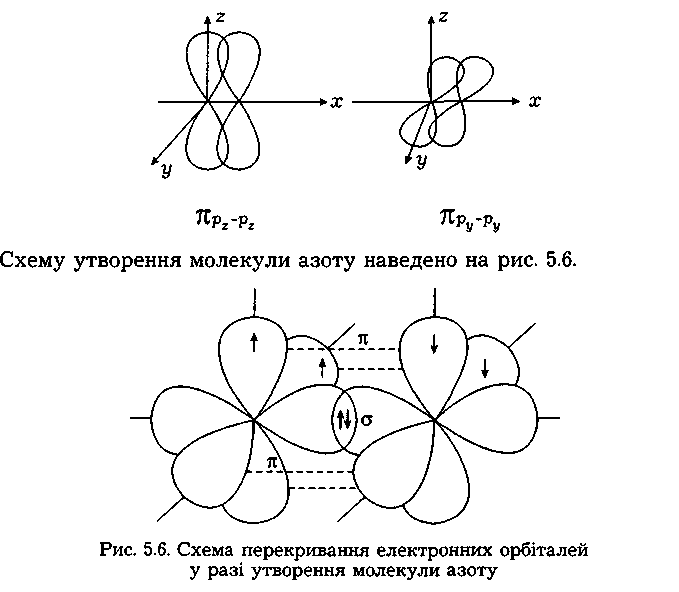
Сигма- (а-), пі- (я-) та дельта- (5-) зв'язки. У наведених прикладах перекривання атомних орбіталей відбувається вздовж ліній, що сполучають ядра атомів. Ковалентні зв'язки подібного типу є в усіх без винятку молекулах, їх називають а-зв'язками (сигма-зв'язок). Атом залежно від числа одноелектронних орбіталей може утворювати кілька ст-зв'язків, але щоразу спільна електронна пара розміщується (локалізується) між ядрами атомів на прямій, що сполучає їх (рис. 5.4).
|
|
s – s а |
s – p б |
|
|
p – p с |
d – d д |
Рис.5.4. Схема перекривання електронних орбіталей у разі утворення - зв’язку
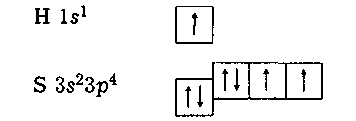
Наприклад,
у молекулі сірководню атом сірки утворює
зв'язки
з кожним із двох атомів водню:
 Згідно з електронно-графічним зображенням
атом сірки має
дві
р-одноелектронні орбіталі, кожна з яких
у разі утворення
двохелектронних
зв'язків має перекритися із s-орбіталлю
атома
водню
(рис. 5.5).
Згідно з електронно-графічним зображенням
атом сірки має
дві
р-одноелектронні орбіталі, кожна з яких
у разі утворення
двохелектронних
зв'язків має перекритися із s-орбіталлю
атома
водню
(рис. 5.5).

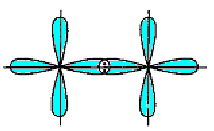
-

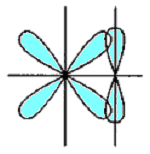
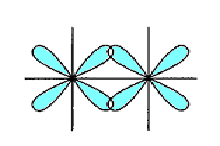
p - p
d - p
d - d
Рис.5.7. Схема перекривання орбіта лей у разі утворення - зв’язку