
- •Физика конденсированного состояния
- •Часть II физика диэлектриков
- •Лабораторная работа № 1 Исследование молекулярных центров с водородной связью, изолированных в матрице ионных кристаллов
- •Введение
- •Классификация водородных связей
- •Методика измерения ик-спектров
- •Вопросы и задания
- •Литература
- •Положение, интенсивность и полуширина f-полосы
- •Порядок выполнения работы
- •Описание установки
- •Задания
- •Контрольные вопросы
- •Литература
- •Экспериментальная установка
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •644077, Г. Омск-77, пр. Мира, 55а, госуниверситет
Классификация водородных связей
Поскольку ИК-спектроскопия была до сих пор важнейшим методом исследования водородных связей, существует классификация, основанная на данных, полученных с помощью этого метода. Согласно [1] можно выделить три основных типа взаимодействия:
1 – слабое взаимодействие, при котором спектр А–Н…В не сильно смещен по отношению к спектру неассоциированных молекул АН;
2 – более сильная водородная связь, которая дает очень широкую полосу в области 1600–3000 см–1 с тремя максимумами (полоса АВС);
3 – очень сильные водородные связи, которые дают очень широкую полосу ниже 1600 см–1. Наличие таких полос свидетельствует о сильной поляризуемости системы.
Спектры
некоторых систем являются промежуточными
между 2 и 3. Нормальные колебания сильной
водородной связи хорошо описываются
линейными точечными группами
![]() и
и
![]() ,
соответственно для связей А–Н–В и
А…Н…А.
,
соответственно для связей А–Н–В и
А…Н…А.
На рис. 1 сопоставлены нормальные колебания сильной водородной связи с эквивалентными колебаниями слабых связей.

Слабая Н-связь Сильная H-связь
мода обозначение мода

A
 – H
…B νs
(AH) A–H–B νs
– валентное симметричное
– H
…B νs
(AH) A–H–B νs
– валентное симметричное
}

A
 – H
…B δ
(AH) A–H–B плоское
деформационное
– H
…B δ
(AH) A–H–B плоское
деформационное
ν2 –
A – H …B γ (AH) A–H–B неплоское деформационное
A – H …B νt (AH) A H–B ν3 – валентное асимметричное
Рис. 1
Обычно
частоты нормальных колебаний располагаются
в следующем порядке:
![]() .
.
Приведенная классификация не позволяет охватить все детали проявлений Н-связи в ИК-спектрах. Например, спектры систем с сильными водородными связями анализировать трудно, так как ниже 1600 см–1 в ИК-спектре наблюдается широкая полоса с перекрывающимися максимумами и окнами. Другой метод классификации водородных связей основан на положении протона в потенциальной яме.
Р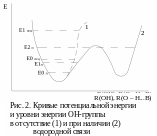 ассмотрим
энергетические уровни ОH-группы,
которая образует водородную связь с
электроотрицательными атомами N,
O,
F,
Cl.
До образования водородной связи ОН-группа
имеет одно нормальное колебание и
одноименную потенциальную функцию
(рис. 2, кривая 1). Взаимодействие между
водородом и электроотрицательным атомом
увеличивает ширину кривой потенциальной
энергии и приводит к формированию
двухъямного потенциала (рис. 2, кривая
2).
ассмотрим
энергетические уровни ОH-группы,
которая образует водородную связь с
электроотрицательными атомами N,
O,
F,
Cl.
До образования водородной связи ОН-группа
имеет одно нормальное колебание и
одноименную потенциальную функцию
(рис. 2, кривая 1). Взаимодействие между
водородом и электроотрицательным атомом
увеличивает ширину кривой потенциальной
энергии и приводит к формированию
двухъямного потенциала (рис. 2, кривая
2).
Н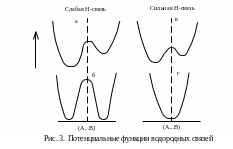 а
языке классической теории это эквивалентно
уменьшению постоянной осциллятора.
С точки зрения принципа неопределенности
увеличение размеров области, в которой
может находиться протон, приводит к
понижению уровней энергии. Изменение
энергии при переходе между двумя
соседними уровнями, очевидно, будет
меньше для конфигурации, связанной
водородной связью, и поэтому
соответствующая полоса поглощения
сдвигается в сторону более, низких
частот. Этот подход позволяет выделить
четыре типа потенциальных ям (рис. 3).
а
языке классической теории это эквивалентно
уменьшению постоянной осциллятора.
С точки зрения принципа неопределенности
увеличение размеров области, в которой
может находиться протон, приводит к
понижению уровней энергии. Изменение
энергии при переходе между двумя
соседними уровнями, очевидно, будет
меньше для конфигурации, связанной
водородной связью, и поэтому
соответствующая полоса поглощения
сдвигается в сторону более, низких
частот. Этот подход позволяет выделить
четыре типа потенциальных ям (рис. 3).
Один из крайних типов (3а) – слабая водородная связь с двумя минимумами энергии, в низшем из которых, а именно вблизи основного атома, находится протон. Другой крайний случай – очень сильная водородная связь с одним минимумом (3г). Существуют и промежуточные связи с двумя эквивалентными минимумами, разделенными высоким (3б) или низким (3в) энергетическим барьером. Определяющим фактором является расстояние между атомами А и В: по мере сближения А и В два минимума сливаются в один. Более подробные сведения о водородной связи можно получить в работах [1–3].
