
- •Российский государственный аграрный заочный университет Кафедра химии. Контрольная работа по дисциплине: Биохимия и молекулярная биология.
- •9) Опишите роль ферментов, относящихся к классу лиаз. Напишите уравнение реакции, происходящей с участием декарбоксилазы.
- •13) Гормоны задней доли гипофиза, их химическая природа и механизм действия на клетку.
- •30) Пути обезвреживания аммиака в организме. Напишите уравнение реакции аспарагина. Где происходит этот процесс и какова биологическая роль аспарагина?
- •49) Биосинтез жирных кислот. Напишите уравнение реакция синтеза масляной кислоты.
- •56) Клетка. Роль клеточных компонентов в процессах метаболизма.
- •71) Синтез белка: процесс транскрипции. Ферменты синтеза п-рнк.
49) Биосинтез жирных кислот. Напишите уравнение реакция синтеза масляной кислоты.
Кроме пищевых жиров источником жирных кислот в организме служит их синтез из глюкозы. Непосредственным предшественником жирных кислот при их синтезе в организме является ацетил-КоА, т. е. то же вещество, которое образуется при р-окислении жирных кислот. Несмотря на то, что все реакции р-окисления обратимы, они не используются для синтеза жирных кислот.
А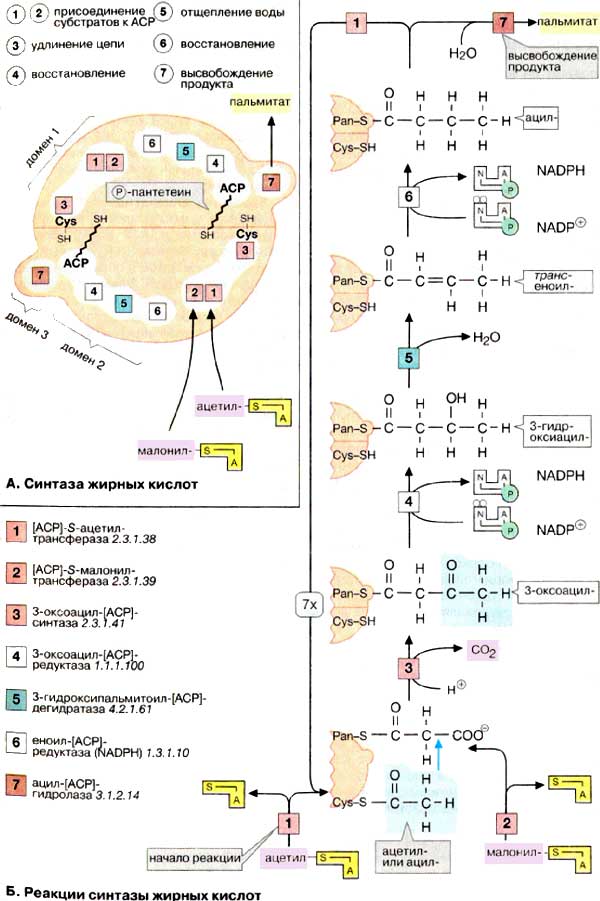 цетил-КоА
для синтеза жирных кислот образуется
путем окислительного де-карбоксилирования
пирувата. Кроме того, окисление и синтез
жирных кислот разделены в пространстве:
окисление происходит в митохондриях,
а синтез — в цитозоле.Перенос ацетильных
остатков из митохондрий в цитозоль.
Пируватдегидрогеназный комплекс
локализован на внутренней поверхности
внутренней мембраны митохондрий, и
ацетил-КоА освобождается в матрикс
митохондрий. Для синтеза жирных кислот
ацетил-КоА должен быть перенесен в
цитозоль. Мембрана митохондрий
непроницаема для ацетил-КоА, и перенос
ацетильного остатка в цитозоль происходит
при участии челночного механизма (рис.
10.5). Пируват, образующийся из глюкозы в
цитозоле, поступает в митохондрии, где
частью превращается в ацетил-КоА
(окислительное декарбоксилирование),
частью — в оксалоацетат (при действии
пи-руваткарбоксилазы). Затем из этих
веществ образуется цитрат, для которого,
как и для пирувата, есть белок-переносчик
в мембране митохондрий. Образование
малонил-КоА. Преобладающая часть
ацетил-КоА, используемого для синтеза
жирных кислот, вначале превращается в
малонил-КоА при действии
ацетил-КоА-карбоксилазы. Синтез
пальмитиновой кислоты. Пальмитилсинтаза
обладает каталитической активностью,
в результате которой ацетильный и
малонильный остатки переносятся на
SH-группу пантотеновой кислоты
(ацилтрансферазная активность) (рис.
10.7, реакции 1 и 2). Далее в реакции 3
ацетильный остаток переносится на место
карбоксильной группы малонильного
остатка; карбоксильная группа при этом
отщепляется в виде С02 (реакция конденсации
двух ацетильных остатков). Затем
последовательно происходят восстановление
р-карбонильной группы (реакция 4),
отщепление воды с образованием двойной
связи между а- и р-углеродны-ми атомами
(реакция 5), восстановление (гидрирование)
двойной связи (реакция 6). В результате
получается остаток четырехуглеродной
жирной кислоты, соединенный с ферментом
(бутирил-Е). Все эти реакции катализируются
разными активными центрами одного
белка: как мы уже отмечали, пальмитилсинтаза
— многофункциональный фермент.
Субъединица пальмитилсинтазы представляет
собой доменный белок, каждый домен
которого катализирует одну из шести
указанных реакций. Промежуточные
продукты остаются постоянно связанными
с ферментом через пантотеновую кислоту,
перемещаясь на этой «привязи» из одного
активного центра в другой.
цетил-КоА
для синтеза жирных кислот образуется
путем окислительного де-карбоксилирования
пирувата. Кроме того, окисление и синтез
жирных кислот разделены в пространстве:
окисление происходит в митохондриях,
а синтез — в цитозоле.Перенос ацетильных
остатков из митохондрий в цитозоль.
Пируватдегидрогеназный комплекс
локализован на внутренней поверхности
внутренней мембраны митохондрий, и
ацетил-КоА освобождается в матрикс
митохондрий. Для синтеза жирных кислот
ацетил-КоА должен быть перенесен в
цитозоль. Мембрана митохондрий
непроницаема для ацетил-КоА, и перенос
ацетильного остатка в цитозоль происходит
при участии челночного механизма (рис.
10.5). Пируват, образующийся из глюкозы в
цитозоле, поступает в митохондрии, где
частью превращается в ацетил-КоА
(окислительное декарбоксилирование),
частью — в оксалоацетат (при действии
пи-руваткарбоксилазы). Затем из этих
веществ образуется цитрат, для которого,
как и для пирувата, есть белок-переносчик
в мембране митохондрий. Образование
малонил-КоА. Преобладающая часть
ацетил-КоА, используемого для синтеза
жирных кислот, вначале превращается в
малонил-КоА при действии
ацетил-КоА-карбоксилазы. Синтез
пальмитиновой кислоты. Пальмитилсинтаза
обладает каталитической активностью,
в результате которой ацетильный и
малонильный остатки переносятся на
SH-группу пантотеновой кислоты
(ацилтрансферазная активность) (рис.
10.7, реакции 1 и 2). Далее в реакции 3
ацетильный остаток переносится на место
карбоксильной группы малонильного
остатка; карбоксильная группа при этом
отщепляется в виде С02 (реакция конденсации
двух ацетильных остатков). Затем
последовательно происходят восстановление
р-карбонильной группы (реакция 4),
отщепление воды с образованием двойной
связи между а- и р-углеродны-ми атомами
(реакция 5), восстановление (гидрирование)
двойной связи (реакция 6). В результате
получается остаток четырехуглеродной
жирной кислоты, соединенный с ферментом
(бутирил-Е). Все эти реакции катализируются
разными активными центрами одного
белка: как мы уже отмечали, пальмитилсинтаза
— многофункциональный фермент.
Субъединица пальмитилсинтазы представляет
собой доменный белок, каждый домен
которого катализирует одну из шести
указанных реакций. Промежуточные
продукты остаются постоянно связанными
с ферментом через пантотеновую кислоту,
перемещаясь на этой «привязи» из одного
активного центра в другой.
56) Клетка. Роль клеточных компонентов в процессах метаболизма.
В прокариотной клетке почти все процессы регулируются. Одна и та же реакция может одновременно подвергаться нескольким видам регуляторного воздействия, неравноценным по направлению и силе действия. Следствием этого является строгая координация активности отдельных метаболических процессов, приводящая к тому, что любой организм в норме представляет собой хорошо отлаженное устройство с системой развитых регуляторных связей. Эффективность клет.регулят. механизмов очень высока. Они обеспечивают максиамльноэкономическое использование питательных веществ среды, предупреждают избыточный синтез промежуточных и конечных метаболитов, отвечают за быструю адаптацию к изменившимся условиям. Регуляция метаболизма сводится к регуляции интенсивности ферментативных реакций. Скорость последних регулируется: путем изменения количества ферментов и/или изменения их активности. Регуляция активности ферментов (Р.А.Ф.) Факторы РАФ делятся на физические (темпер., давление, свет, магнит. поле, электр. импульсы)оказывают меньшее действие, чем химические. Одни хим. вещ-ва связываются сактивным ценром фермента (субстраты, кофакторы, конкуретные ингебиторы), что приводит к изменению ферментативной активности. Другие вещества взаимодействуют со специальными участками на поверхности молекулы определенного типа фермента, не имеющими непосредственного отношения к центрам каталитической активности, но приводящими к ее изменению. Р.А.Ф. происходит путем химической модификации их молекулы, в основе которой лежит ковалентное обратимое связывание с ферментом определенной группировки, что приводит к изменению его активности. Наиболее быстрым и тонким механизмом Р.А.Ф. является регуляция, которой подвергается определенный тип ферментов, получивших названиеаллостерических. Наиболее простой случай аллостерической регуляции – регуляция первого фермента неразветвленного биосинтетического пути его конечным продуктом. Некоторые аллостеричекие ферменты существуют в виде нескольких молекулярных форм (изоферментов). Регуляция синтеза ферментов. Регулирование конечным продуктом активности аллостерического фермента определенного биосинтетического пути обеспечивает мгновенную реакцию, приводящую к изменению выхода этого продукта. Если последний оказывается ненужным, отпадает надобность и в ферментах, участвующих в его синтезе. Очевидна нужность синтеза только тех ферментов, которые необходимы в конкретных условиях. У прокариот в одних условиях фермент может содержаться в количестве не более 1-2 молекул, в других – составлять несколько процентов от клеточной массы. Количество определенного фермента в клетке может регулироваться на нескольких уровнях: на этапе транскрипции, трансляции, в процессе сборки и разрушения ферментативного белка. Специфические химические сигналы могут инициировать или блокировать транскрипцию определенного участка ДНК в иРНК. Регуляция синтеза ферментов на этапе транскрипции основана на том, что «считывание» бактериальных генов происходит избирательно и скорость образования копий соответствующих иРНК находится под сложным контрольным механизмом. Ферменты, синтез которых в растущей клетке происходит с постоянной скоростью в результате постоянного транскрибирования соответствующих генов, они присутствуют в клетке в более или менее постоянной концентрации, называются конститутивными. К ним относят, например гликолитические ферменты. Метаболические пути, функционирующие с участием конститутивных ферментов, контролируются посредством других регуляторных воздействий, аллостерического ингибипования.
