
- •Занятие 13
- •Цель занятия
- •3. Гидроксид алюминия является лёгким аморфным осадком. Его оптимальная масса, как осаждаемой формы, при гравиметрическом определении составляет примерно:
- •4. При проведении гравиметрических определений методом осаждения навеску исходного вещества растворяют в воде (или другом растворителе) в таком соотношении, чтобы получился примерно:
- •5. Что из перечисленного неверно?
- •Предварительные расчёты
- •Занятие 14
- •Цель занятия
- •Результаты, полученные студентами первой группы
- •Занятие 15
- •Занятие 16
- •Цель занятия
- •2. Обратное титрование применяют, если:
- •3. В процессе косвенного титрования:
- •4. Согласно методике анализа Вам необходимо добавить к анализируемому раствору 10,00 мл стандартного раствора титранта. Какой мерной посудой Вы воспользуетесь?
- •5. Что из перечисленного неверно?
- •1. Проверка вместимости мерной колбы
- •2. Проверка вместимости пипетки
- •3. Проверка вместимости бюретки
- •Проверка вместимости бюретки
- •4. Определение объёма капли
- •Занятие 17
- •Цель занятия
- •9. Какие из перечисленных ниже индикаторов в водном растворе, имеющем рН 2, будут окрашены в красный цвет?
- •10. К 10 мл 0,1 м раствора вещества 0,1 моль/л добавляют 1 каплю 1% этанольного раствора фенолфталеина. В растворах каких веществ при этом произойдёт появление окраски?
- •1. Приготовление и стандартизация 0,1 м hCl
- •2. Приготовление и стандартизация 0,1 м koh
- •Занятие 18
- •Цель занятия
- •10. Что из перечисленного ниже неверно?
- •Цель занятия
- •Цель занятия
- •Занятие 21
- •Цель занятия
- •1. Приготовление и стандартизация 0,05 м эдта
- •2. Комплексонометрическое определение сульфата цинка
- •3. Комплексонометрическое определение хлорида кальция
- •Занятие 22
- •Цель занятия
- •1. Что из перечисленного верно?
- •1. Стандартизация 0,1м AgNo3
- •2. Аргентометрическое определение ki
- •Занятие 23
- •Цель занятия
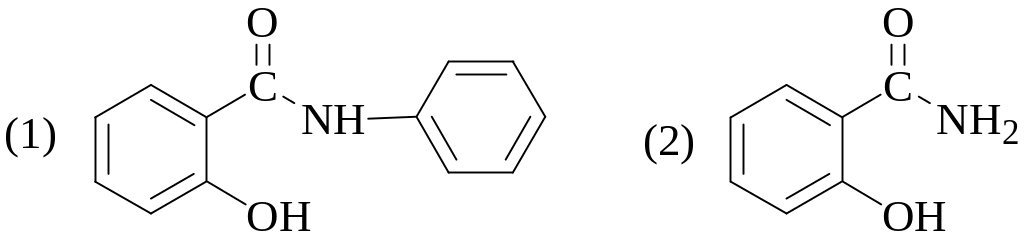
- •3. Какая из перечисленных ниже формул принадлежит n-фенилантраниловой кислоте?
- •5. Редуктор Джонса:
- •10. Реактив к.Фишера представляет собой смесь:
- •1. Стандартизация раствора тиосульфата натрия
- •2. Иодометрическое определение пероксида водорода
- •Цель занятия
- •1. Какие из веществ, формулы которых приведены ниже, могут быть определены методом нитритометрического титрования на основе реакции диазотирования?
- •2. Что из перечисленного ниже верно?
- •1. Приготовление и стандартизация 0,1 м NaNo2
- •2. Нитритометрическое определение стрептоцида
- •Занятие 25
- •Цель занятия
- •1. Стандартизация 0,05 м 1/5kMnO4
- •2. Перманганатометрическое определение пероксида водорода
- •Занятие 26
- •Цель занятия
Цель занятия
Знать:
основные принципы и закономерности кислотно-основного титрования в неводных средах;
критерии выбора растворителя для кислотно-основного титрования;
титранты, стандартные вещества и индикаторы неводного титрования, используемые в фармацевтическом анализе;
способы определения солей аммония, а также принципы, положенные в основу метода определения азота в органических соединениях.
Уметь:
проводить количественное определение соли аммония способом обратного титрования
Способы титриметрического определения солей аммония.
Определение азота в органических соединениях методом Кьельдаля.
Ограничение возможностей кислотно-основного титрования в водных растворах. Понятие о неводном титровании.
Критерии выбора растворителя для кислотно-основного титрования. Константа титрования.
Титранты, стандартные вещества и индикаторы, используемые при кислотно-основном титровании в неводных средах.
Определение оснований методом кислотно-основного титрования в неводных средах.
Определение кислот методом кислотно-основного титрования в неводных средах.

Почему ион аммония не может быть количественно определён в водном растворе способом прямого кислотно-основного титрования? Напишите уравнения реакций, протекающих при определении данного вещества способом обратного титрования и титрования заместителя (с использованием формальдегида).
Формальдегид может быть использован в качестве вспомогательного реагента при алкалиметрическом определении аминокислот («формольное титрование»). Напишите уравнения химических реакций, протекающих при таком определении (на примере аминоуксусной кислоты).
Опишите возможные преимущества и недостатки двух способов определения аммиака, образующегося в процессе определения азота в органических соединениях методом Кьельдаля. С помощью какого индикатора (фенолфталеина или метилового оранжевого) обнаруживают конечную точку титрования в обоих случаях?
Для какого из веществ
при определении по методу Кьельдаля требуется длительное (2,5-3 часа) кипячение в концентрированной серной кислоте в присутствии K2SO4, CuSO4 и Se и для какого достаточно щелочного гидролиза без проведения предварительной минерализации?
В каких случаях вода не может быть использована в качестве среды для проведения кислотно-основного титрования?
Какие факторы определяют выбор неводного растворителя при кислотно-основном титровании? Что такое константа титрования? Почему в качестве протогенного растворителя при неводном титровании применяют уксусную кислоту, а не муравьиную или серную?
Что такое «ледяная уксусная кислота». Почему она так называется? Являются ли термины «ледяная уксусная кислота» и «безводная уксусная кислота» синонимами?
Представьте, что Вы определяете некое вещество, обладающее основными свойствами, путём титрования его в среде CH3COOH. Анализируемым объектом является водный раствор. Вода, присутствующая в нём, будет мешать определению. Каким образом можно от неё избавиться?
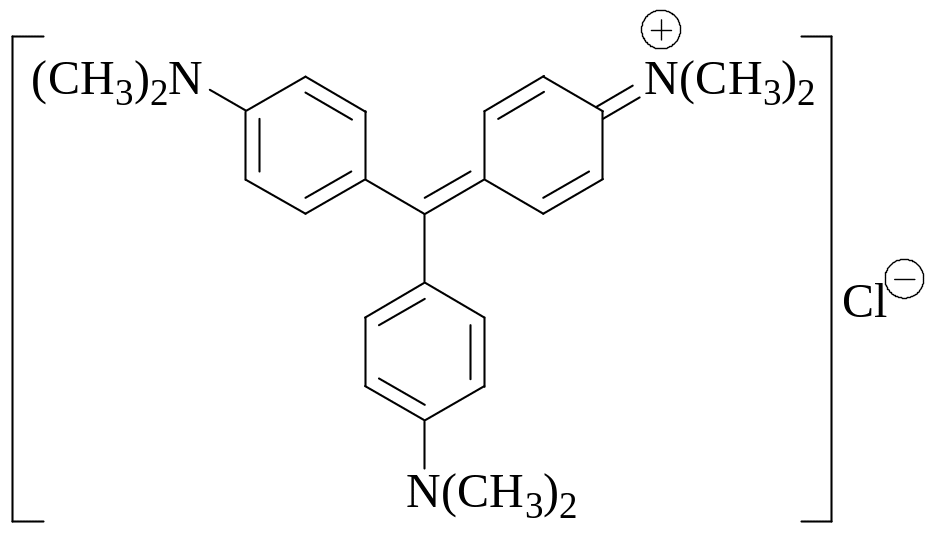
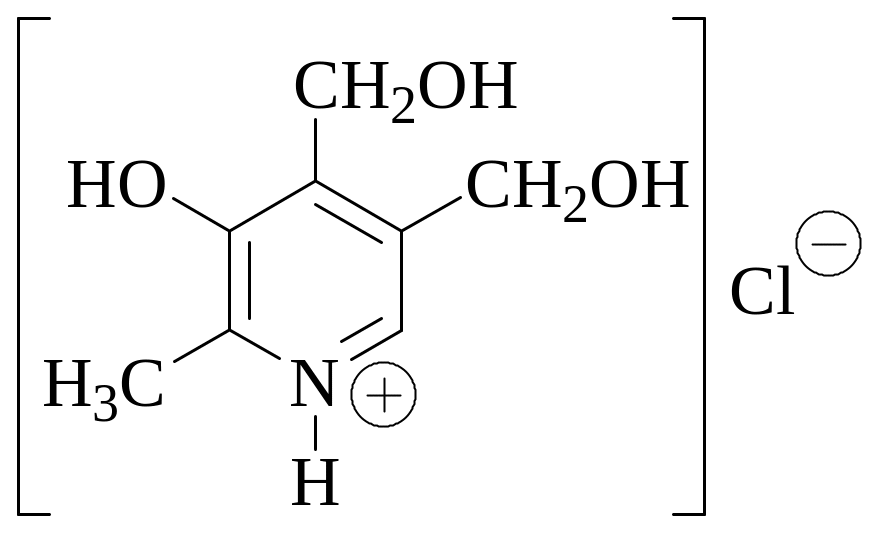
Вещество, формула которого приведена ниже, используется в качестве индикатора при кислотно-основном титровании в неводных средах. Как оно называется? К какому классу индикаторов (в зависимости от химического строения) оно относится? При титровании в каких растворителях оно используется?
Ниже приведена формула неизвестного Вам лекарственного вещества. Его количественное определение проводят по следующей методике: точную навеску растворяют в ацетоне, добавляют к полученному раствору раствор Hg(CH3COO2) в CH3COOH и проводят титрование раствором хлорной кислоты. По какому компоненту: катиону или аниону проводится титриметрическое определение лекарственного вещества в описанной методике. Какую роль при этом играет ацетат ртути (II)? Чему равен фактор эквивалентности данного вещества при таком определении?
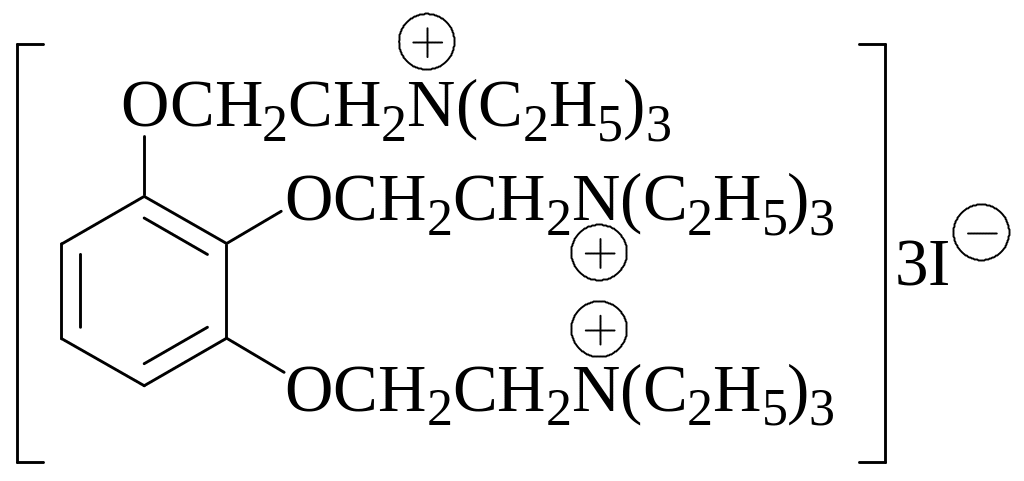
1. Ниже приведена схема прибора для определения азота в органических соединениях? В какую часть данного прибора помещают навеску определяемого вещества?
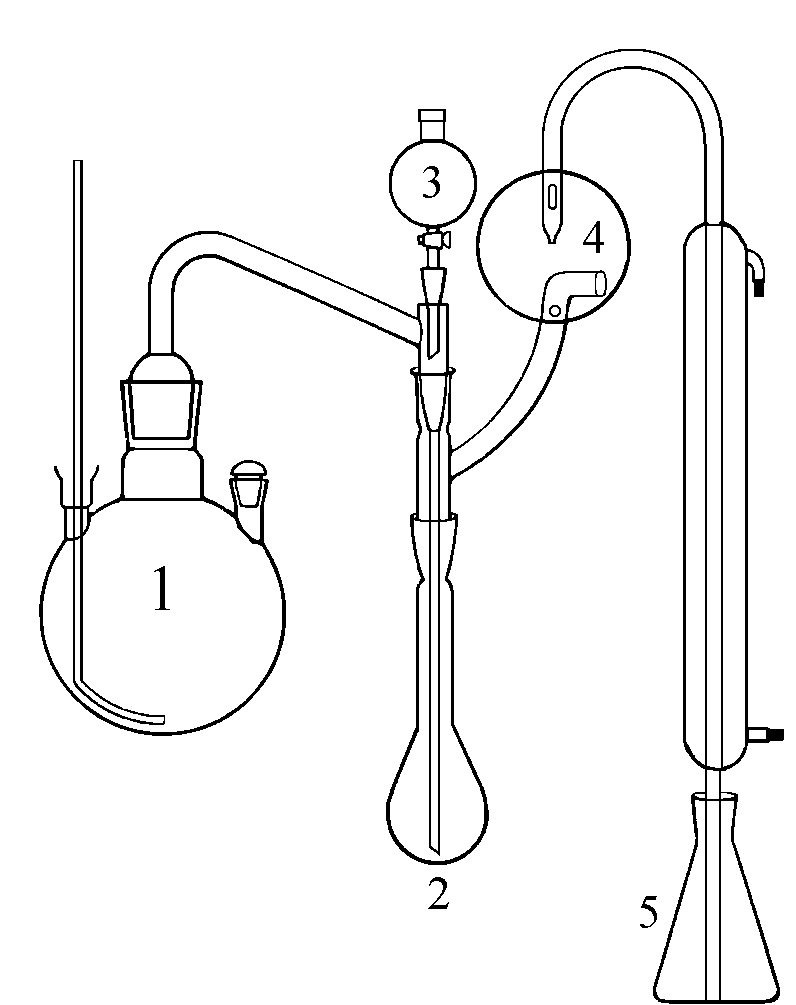
номер 1; 2) номер 2; 3) номер 3; 4) номер 4;
5) номер 5.
2. Что из перечисленного не используется при определении азота в органических соединениях методом Кьельдаля?
1) HClO4; 2) HCl; 3) H2SO4; 4) NaOH; 5) CH3COOH
3. Фактор эквивалентности для аминоуксусной кислоты при её определении методом Кьельдаля равен:
1) 1/4; 2) 1/2; 3) 1; 4) 2; 5) 3.
4. Величина рKT титрования мочевины (рKBH+ = 7,65) в уксусной кислоте (pKSH = 14,4) равна:
1) 6,75; 2) 22,05; 3) 7,65; 4) 14,4; 5) –6,75.
5. Что из перечисленного ниже неверно?
1) для неводного титрования лучше всего подходят растворители, имеющие большую константу автопротолиза;
2) для неводного титрования лучше всего подходят растворители, имеющие малую константу автопротолиза;
3) растворитель, используемый при определении оснований, сам должен обладать выраженными основными свойствами;
4) диэлектрическая проницаемость растворителей, используемых в неводном титровании, не должна превышать 5;
5) растворитель, используемый при определении кислот, должен обладать хорошей протоноакцепторной способностью.
6. Какие из перечисленных характеристик соответствуют уксусной кислоте?
1) полярный растворитель; 2) неполярный растворитель;
3) растворитель, нивелирующий силу сильных в воде кислот;
4) апротонный растворитель; 5) протогенный растворитель.
7. Какие из перечисленных растворов используют в качестве титрантов при определении веществ в среде уксусной кислоты?
NaOH в воде; 2) HCl в уксусной кислоте;
3) CH3COONa в уксусной кислоте; 4) HClO4 в уксусной кислоте;
5) CH3ONa в бензоле.
8. Что из перечисленного ниже используется в качестве первичного стандартного вещества для стандартизации растворов HClO4 в уксусной кислоте?
1) бензойная кислота; 2) гидрофталат калия; 3) ацетат ртути (II)
4) гидрокарбонат натрия; 5) дибутилфталат
9. Какие из перечисленных растворов не используют в качестве титрантов при определении веществ в среде диметилформамида?
раствор NaOH в смеси бензола и метанола;
раствор NaOH в воде;
раствор HCl в метаноле;
раствор CH3COONa в уксусной кислоте;
раствор CH3ONa в смеси метанола и бензола.
10. Что из перечисленного верно? Тимоловый синий:
азоиндикатор;
используется для обнаружения конечной точки кислотно-основного титрования в среде уксусной кислоты;
в 0,01 М HCl – синий, а в 0,01 М NaOH - жёлтый;
сульфофталеиновый индикатор;
используется для обнаружения конечной точки кислотно-основного титрования в среде диметилформамида.
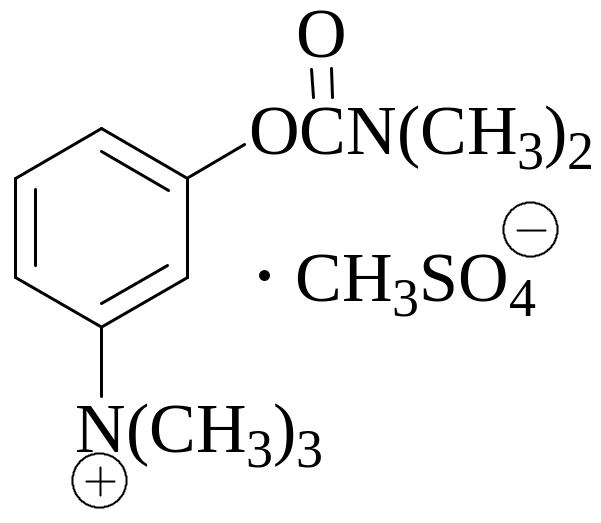
Методика определения прозерина, приведенная в условии задачи, основана на том, что при щелочном гидролизе данного вещества образуется диметиламин, который затем поглощают раствором борной кислоты и титруют образовавшийся ион BO2- раствором HCl.
ROCON(CH3)2 + 3NaOH RONa + Na2CO3 + (CH3)2NH + H2O
(CH3)2NH + H3BO3 (CH3)2NH2BO2 + H2O
(CH3)2NH2BO2 + HCl + H2O (CH3)2NH2Cl + H3BO3
Как видно из приведенных уравнений реакций, фактор эквивалентности прозерина равен 1. Массу прозерина, содержащегося в 1 мл анализируемого раствора, можно рассчитать по следующей формуле:
![]()
![]() г
г
Смесь хлоридов натрия, калия и аммония массой 0,2152 г растворили в 25,00 мл 0,1236 М NaOH. Для титрования непрореагировавшей щёлочи после кипячения полученного раствора, с целью удаления NH3, и охлаждения потребовалось 10,50 мл раствора HCl, имеющего титр по NaOH 4,10010-3 г/мл. Рассчитайте массовую долю NH4Cl в анализируемой смеси. Ответ: 50,06%
Раствор метилата натрия в смеси метанола и бензола используется в качестве титранта в неводном титрования. Навеску перекристаллизованной бензойной кислоты массой 0,1190 г растворили в 10 мл диметилформамида, нейтрализованного по тимоловому синему. Для титрования полученного раствора в присутствии тимолового синего потребовалось 9,70 мл стандартизируемого раствора CH3ONa. Рассчитайте молярную концентрацию CH3ONa в данном растворе, его титр и титр по бензойной кислоте. Ответ: 0,1005 моль/л; 5,42910-3 г/мл; 1,22710-2 г/мл.
Ацетат калия (М = 98,15 г/моль) используется в медицине в качестве мочегонного средства. Навеску высушенного при 110 С образца ацетата калия массой 0,0790 г растворили в 10 мл CH3COOH и оттитровали 0,1015 М HClO4. Рассчитайте массовую долю CH3COOK в анализируемом образце, если для титрования было израсходовано 8,10 мл, а в контрольном опыте 0,20 мл раствора хлорной кислоты. Ответ: 99,6%;
Л
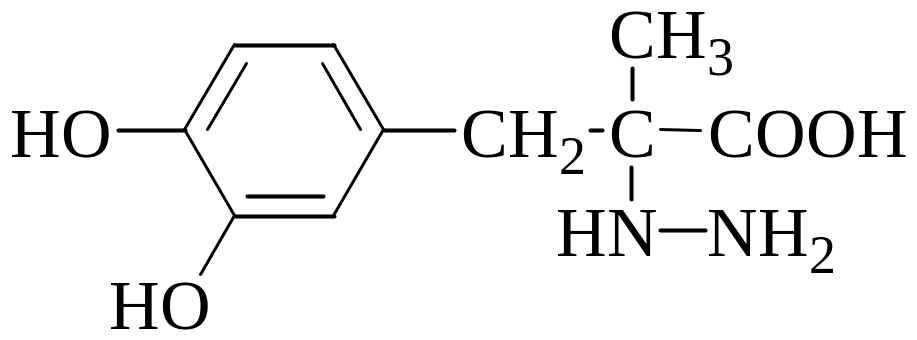 екарственное
вещество карбидопа (М = 226,2 г/моль)
применяется для лечения болезни
Паркинсона. Навеску образца карбидопы
массой 0,3015 г растворили в 25,00 мл 0,1040 М
HClO4 в CH3COOH.
Для титрования избытка хлорной кислоты
потребовалось 12,80 мл 0,1000 М CH3COONa
в CH3COOH.
Рассчитайте массовую долю карбидопы
в анализируемом образце, если она
взаимодействует с хлорной кислотой в
молярном отношении 1:1. Ответ: 99,03%;
екарственное
вещество карбидопа (М = 226,2 г/моль)
применяется для лечения болезни
Паркинсона. Навеску образца карбидопы
массой 0,3015 г растворили в 25,00 мл 0,1040 М
HClO4 в CH3COOH.
Для титрования избытка хлорной кислоты
потребовалось 12,80 мл 0,1000 М CH3COONa
в CH3COOH.
Рассчитайте массовую долю карбидопы
в анализируемом образце, если она
взаимодействует с хлорной кислотой в
молярном отношении 1:1. Ответ: 99,03%;Ф
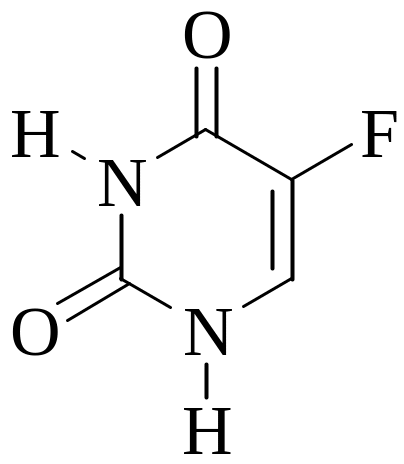 торурацил
(М = 130,1 г/моль) используется для лечения
онкологических заболеваний. Навеску
образца фторурацила массой 0,3840 г
растворили в 80 мл диметилформамида.
Для титрования полученного раствора
с индикатором тимоловым синим
потребовалось 28,00 мл 0,1000 М гидроксида
тетрабутиламмония. Рассчитайте массовую
долю фторурацила в испытуемом образце.
Фторурацил в условиях данного определения
является одноосновной кислотой. Ответ:
94,86%.
торурацил
(М = 130,1 г/моль) используется для лечения
онкологических заболеваний. Навеску
образца фторурацила массой 0,3840 г
растворили в 80 мл диметилформамида.
Для титрования полученного раствора
с индикатором тимоловым синим
потребовалось 28,00 мл 0,1000 М гидроксида
тетрабутиламмония. Рассчитайте массовую
долю фторурацила в испытуемом образце.
Фторурацил в условиях данного определения
является одноосновной кислотой. Ответ:
94,86%.
Навеску массой 0,8020 г смеси хлорида натрия и хлорида аммония растворили в 40 мл воды, прибавили 40 мл раствора формальдегида, предварительно нейтрализованного по фенолфталеину, и оттитровали выделившуюся кислоту 0,4980 М NaOH. Рассчитайте массовую долю хлорида аммония в смеси, если для титрования было израсходовано 19,10 мл раствора щёлочи.
Навеску массой 0,2035 г образца лекарственного средства, содержащего HgO, обработали водным раствором иодида калия:
HgO + 4КI + H2O K2[HgI4] + 2KOH
выделившийся KOH оттитровали раствором HCl, имеющим титр по KOH 5,72310-3 г/мл. Рассчитайте массовую долю HgO в анализируемом образце, если для титрования было израсходовано 15,40 мл раствора HCl.
Навеску массой 0,3995 г образца лекарственного вещества теофиллина (M = 180,2 г/моль) растворили в 100 мл кипящей воды. К охлаждённому раствору прибавили 25 мл 0,1 М AgNO3, 1 мл раствора фенолового красного и оттитровали выделившуюся кислоту 0,1000 М NaOH. Рассчитайте массовую долю теофиллина в анализируемом образце, если для титрования было израсходовано 22,10 мл раствора щелочи.
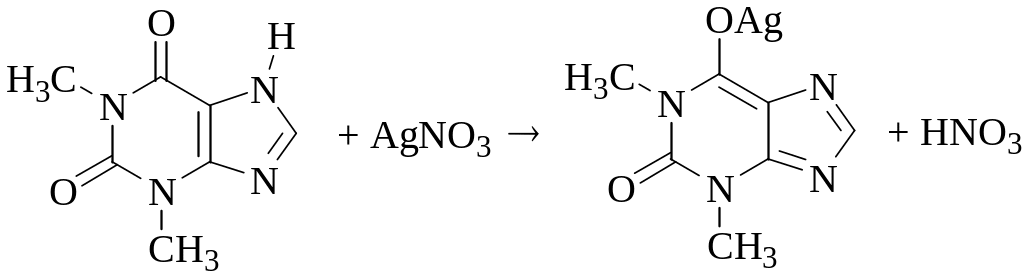
Навеску массой 0,3120 г образца хлоралгидрата (M = 165,40 г/моль) - лекарственного вещества, обладающего противосудорожным и снотворным действием, растворили в 35,00 мл 0,1035 М NaOH. После того, как прошла реакция
CCl3CH(OH)2 + NaOH CHCl3 + HCOONa + H2O,
непрореагировавший гидроксид натрия оттитровали 0,1010 М HCl. Рассчитайте массовую долю хлоралгидрата в анализируемом образце, если для титрования потребовалось 18,00 мл раствора кислоты.
Пробу гексаметилентетрамина (M = 140,19 г/моль) массой 0,1200 г растворили в 10 мл воды. К полученному раствору добавили 50,0 мл 0,1000 М 1/2 H2SO4. После кипячения в течение 30 минут и охлаждения непрореагировавшую кислоту оттитровали 0,1100М NaOH, для чего потребовалось 18,80 мл раствора щёлочи. Рассчитайте массовую долю гексаметилентетрамина в анализируемой пробе.
Пробу лекарственного вещества неостигмина метилсульфата (M = 333,4 г/моль) массой 0,1500 г растворили в 20 мл воды и подвергли гидролизу действием гидроксида натрия. Выделившийся диметиламин собрали в 50,0 мл 0,0100 М H2SO4. Избыток кислоты оттитровали 0,0200 М NaOH. Рассчитайте массовую долю неостигмина метилсульфата в анализируемой пробе, если для титрования было израсходовано 27,60 мл раствора щёлочи.
Стандартный раствор (0,1 моль/л) HClO4 в ледяной уксусной кислоте готовят по следующей методике. Определённый объём 57% или 72%-ного водного раствора HClO4 растворяют в 500 мл ледяной уксусной кислоты. Затем к полученному раствору для удаления лишней воды прибавляют некоторое количество уксусного ангидрида. После охлаждения раствор доводят ледяной уксусной кислотой до объёма 1 л. Приготовленный раствор должен содержать не менее 0,01% и не более 0,2% воды. Для стандартизации полученного раствора применяют гидрофталат калия. Рассчитайте:
![]() объём
раствора с массовой долей HClO4
57% (пл. 1,50 г/мл) необходимый для приготовления
1 л раствора;
объём
раствора с массовой долей HClO4
57% (пл. 1,50 г/мл) необходимый для приготовления
1 л раствора;
объём уксусного ангидрида (пл. 1,08 г/мл), который следует добавить к полученному раствору, чтобы с водным раствором HClO4 в 1 л конечного раствора (пл. 1,05 г/мл) попало не более 0,1% масс. H2O.
точную молярную концентрацию HClO4 в приготовленном растворе, если для титрования навески гидрофталата калия (M = 204,22 г/моль) массой 0,1620 г было израсходовано 8,95 мл этого раствора.
Лекарственное вещество декамин (M = 527,6 г/моль) обладает антимикробным и противогрибковым действием (формулу декамина – см. С. 172). Навеску образца декамина массой 0,2200 г растворили в смеси уксусной кислоты, уксусного ангидрида и раствора Hg(CH3COO)2 в уксусной кислоте. Для титрования полученного раствора потребовалось 8,20 мл 8,9510-2 М HClO4. Рассчитайте массовую долю декамина в образце, если в контрольном опыте для титрования было израсходовано 0,22 мл стандартного раствора титранта.
Навеску растёртых таблеток массой 0,1520 г, содержащих фенобарбитал (М = 232,24 г/моль) - лекарственное вещество снотворного и противосудорожного действия, растворили в 10 мл диметилформамида. Для титрования полученного раствора потребовалось 3,40 мл 0,1005 М NaOH в смеси метанола и бензола. Чему равна масса фенобарбитала в расчёте на среднюю массу одной таблетки, если 20 анализируемых таблеток имеют массу 4,050 г, а 1 моль фенобарбитала при титровании взаимодействует с 1 моль NaOH.
Пробу инъекционного раствора пиридоксина гидрохлорида (витамина B6) объёмом 2,00 мл нагрели с 40 мл уксусного ангидрида. После охлаждения к полученному раствору добавили 10 мл безводной CH3COOH, 5 мл раствора Hg(CH3COO)2 в CH3COOH и провели титрование его 0,1022 М HClO4. Рассчитайте массу пиридоксина гидрохлорида в 1 мл испытуемого раствора, если для титрования пробы было израсходовано 2,48 мл, а в контрольном опыте - 0,05 мл раствора хлорной кислоты. Молярная масса пиридоксина гидрохлорида равна 205,64 г/моль.
ОПРЕДЕЛЕНИЕ ХЛОРИДА АММОНИЯ СПОСОБОМ ОБРАТНОГО ТИТРОВАНИЯ
При определении способом обратного титрования к соли аммония добавляют взятый в заведомом избытке точный объём стандартного раствора NaOH. Раствор кипятят до полного удаления аммиака
NH4Cl
+ NaOH
![]() NH3
+ NaCl + H2O
NH3
+ NaCl + H2O
Избыток щелочи, не вступивший в реакцию, оттитровывают стандартным раствором HCl.
Определение хлорида аммония способом обратного титрования проводят по следующей методике. Вначале готовят раствор с приблизительной концентрацией NH4Cl 0,1 моль/л. Для приготовления 100,0 мл такого раствора следует взять примерно m = 53,50,10,1 = 0,54 г анализируемого образца.
Точную навеску анализируемого образца растворяют в воде в мерной колбе вместимостью 100,0 мл, доводят водой до метки и перемешивают. В 3 колбы для титрования пипеткой отмеривают по 10,00 мл полученного раствора, прибавляют в каждую колбу по 20,00 мл 0,1 М NaOH, нагревают на плитке до кипения и кипятят примерно 10 минут до полного удаления аммиака (полноту удаления аммиака контролируют индикаторной бумажкой). После охлаждения добавляют в каждую колбу по 2-3 капли раствора метилового оранжевого и титруют 0,1 М HCl до оранжевого окрашивания.
Расчёт массовой доли NH4Cl в анализируемом образце проводят по следующей формуле
![]()
где V(NaOH) = 20,00 мл, V(HCl) - объём раствора HCl (мл), затраченные на титрование избытка щёлочи (берут средние значения для трёх определений); M(NH4Cl) = 53,49 г/моль, Vк = 100,0 мл, Vп = 10,00 мл.
Титр 0,1000 М HCl по хлориду аммония равен 53,490,100010-3 = 5,34910-3 г/мл. При использовании его значения и в том случае, если C(HCl) = C(NaOH), расчётная формула имеет следующий вид
![]()
ЗАНЯТИЕ 20

