- •Раздел 1
- •Занятие 1
- •Цель занятия
- •Карбонаты щелочных металлов
- •Отделение ионов аммония
- •Действие щелочей и аммиака
- •Оксалат аммония
- •Родизонат натрия (или калия)
- •Занятие 2
- •Цель занятия
- •1. На чем основано разделение катионов согласно кислотно-основной классификации?
- •2. В какой строке перечислены все групповые реагенты, используемые в кислотно-основной схеме анализа?
- •Цель занятия
- •Цель занятия
- •Салициловая кислота (сульфосалициловая кислота)
- •Цель занятия
- •1. В растворе присутствуют hCl (0,1 моль/л) и h3bo3 (0,01 моль/л). Что можно сказать о рН данного раствора?
- •Действие щелочей
- •Действие щелочей
- •Действие щелочей
- •Гексацианоферрат (II) калия
- •Цель занятия
- •1. Что из перечисленного ниже верно? Гидроксиды алюминия, цинка, хрома (III) растворимы в:
- •5. Найдите ряд, в котором содержится больше всего катионов, выпадающих в осадок в виде гидроксидов и оксосолей при обработке анализируемого раствора избытком 6 м NaOh и 6 м nh3.
- •Цель занятия
- •5. Обнаружение анионов scn- и I-
- •Цель занятия
- •Занятие 9
- •Цель занятия
- •1. В насыщенном водном растворе какого из перечисленных ниже веществ равновесная концентрация ионов металла будет наименьшей (в скобках приведены значения ks)?
- •Занятие 10
- •Цель занятия
- •1. Какие из перечисленных ниже процессов невозможны (дайте ответ, не проводя расчётов)?
- •2. Какая из частиц, выделенных полужирным шрифтом, является самым сильным окислителем?
- •3. Какая из частиц, выделенных полужирным шрифтом, является самым сильным восстановителем?
- •7. Какой из малорастворимых электролитов, формулы которых приведены ниже, обладает самым малым произведением растворимости?
- •9. Вывод об отсутствии какого ряда анионов можно сделать, если известно, что при добавлении к анализируемому раствору разбавленного раствора сильной кислоты не происходит выделения пузырьков газа?
- •10. При добавлении к анализируемому раствору ki в кислой среде не происходит появления бурой окраски вследствие выделения иода. Все анионы какого ряда можно не искать при дальнейшем анализе?
- •Занятие 11
- •Цель занятия
- •Предварительные испытания
- •Занятие 12
- •Цель занятия
- •4. Какой из приведенных ниже графиков отражает зависимость константы распределения предельных монокарбоновых кислот между хлороформом и водой в зависимости от числа атомов углерода в молекуле кислоты?
- •2. Экстракция диметилглиоксиматов никеля и кобальта
- •3. Экстракция соединения комплексного аниона [SbCl6]- с малахитовым зеленым
- •4. Экстракционное разделение I- и Br-
- •5. Экстракция ионного ассоциата берберина с трихлорацетат-анионом
- •6. Экстракция ионного ассоциата димедрола с метиловым оранжевым
- •Раздел 2
1. На чем основано разделение катионов согласно кислотно-основной классификации?
на различной растворимости фосфатов в воде, кислотах, щелочи, водном растворе NH3;
на различной растворимости хлоридов, сульфатов и гидроксидов в воде, растворе щелочи, водном растворе аммиака;
на различной растворимости сульфидов, карбонатов в воде;
на различной растворимости сульфидов в воде, сильных кислотах и водном растворе сульфида аммония;
на различной растворимости сульфидов, фосфатов и гидроксидов в воде, растворе серной кислоты и этаноле.
2. В какой строке перечислены все групповые реагенты, используемые в кислотно-основной схеме анализа?
1) HCl, H2SO4, (NH4)2CO3, (NH4)2S;
2) NaOH или KOH, H2O2, (NH4)2CO3, HCl, HNO3;
3) HCl, H2SO4, NaOH или KOH, NH3;
4) HCl, HNO3, (NH4)3 PO4, NH3;
5) H2SO4, HNO3, HCl, H2O2.
3. Какой из приведенных реагентов используют для отделения Pb2+, Ag+, Hg22+ от других катионов по кислотно-основной схеме анализа?
2 М HCl;
2) 2 М H2SO4;
3) 6 M NaOH;
4) 6 M NH3 ;
5) 2 M (NH4)2CO3.
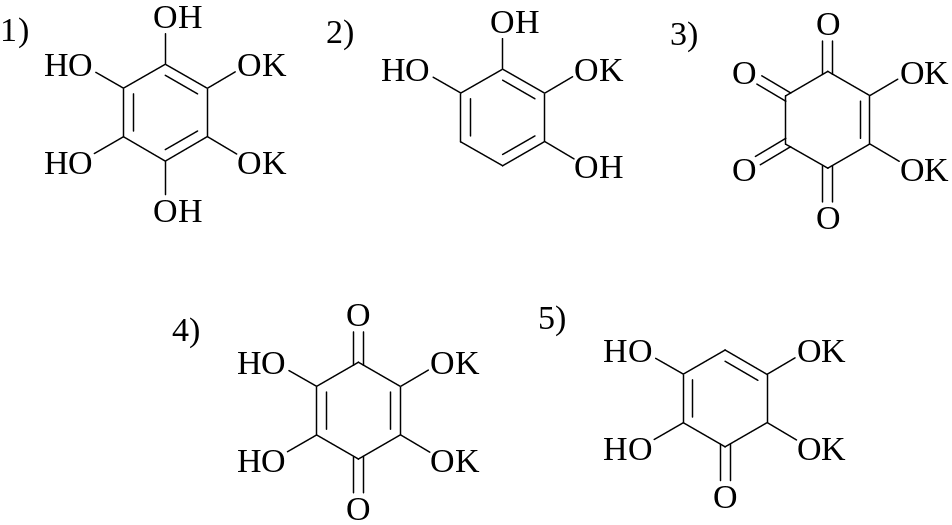
4. Какая из перечисленных ниже формул соответствует родизонату калия?
5. Что из перечисленного ниже верно?
1) сульфаты кальция, стронция и бария растворимы в 1 М NH3;
2) сульфаты кальция, стронция и бария растворимы в 1 М NaOH;
3) сульфат бария легко растворим в 1 М HCl, в то время как сульфат кальция и стронция только в 2 М HCl;
4) сульфаты кальция, стронция и бария не растворимы в 1 М HCl и 1 М NaOH;
5) сульфаты кальция, стронция и бария растворимы в этаноле.
АНАЛИЗ РАСТВОРА, СОДЕРЖАЩЕГО КАТИОНЫ I-III АНАЛИТИЧЕСКИХ ГРУПП
В предлагаемом для исследования растворе могут содержаться ионы K+, NH4+, Pb2+, Ag+, Ca2+, Ba2+.
Химическое исследование раствора проводят по следующей схеме. Вначале проводят предварительные испытания:
![]() Отмечают
окраску и рН раствора.
Отмечают
окраску и рН раствора.
С помощью раствора NaOH и индикаторной бумажки проводят обнаружение катионов NH4+.
С помощью 2 М HCl проводят обнаружение катионов 2-й аналитической группы. Если осадок не образуется, то катионов Ag+ и Pb2+ в исследуемом растворе нет.
Обнаружение катионов III аналитической группы проводят с помощью 2 М H2SO4. Если осадок не образуется (после добавления этанола), то можно сделать вывод об отсутствии в исследуемом растворе катионов Ca2+ и Ba2+. Катионы Pb2+ могут давать осадок как с HCl, так и с H2SO4. Осадок PbSO4 в отличие от CaSO4 и BaSO4 растворим в растворе NaOH.
Обнаружение катионов K+ проводят с помощью микрокристаллоскопической реакции с Na2Pb[Cu(NO2)6]. Если в растворе присутствуют ионы NH4+, то их можно удалить прокаливанием 1 капли раствора на предметном стекле. К остывшему сухому остатку прибавляют 2 капли раствора Na2Pb[Cu(NO2)6]. Образовавшиеся чёрные кубические кристаллы рассматривают под микроскопом.
Предварительные испытания позволяют упростить дальнейшее исследование, так как в растворе может не оказаться целой группы катионов.
После завершения предварительных испытаний берут около 0,5 мл исследуемого раствора и добавляют к нему 0,5 мл 2 М HCl. Образовавшийся осадок отфильтровывают с помощью бумажного фильтра. Фильтрат оставляют для обнаружения Ca2+ и Ba2+.
Фильтр с осадком обрабатывают 2-3 мл горячего 30% раствора CH3COONH4. В фильтрате с помощью реакции с KI обнаруживают ионы Pb2+.
Осадок, оставшийся на фильтре после обработки его раствором CH3COONH4, обрабатывают 2-3 мл 2 М NH3. В фильтрате реакцией с K2CrO4 обнаруживают катионы Ag+.
Для обнаружения катионов Ca2+ 1 каплю фильтрата, оставленного для обнаружения катионов Ca2+ и Ba2+, помещают на предметное стекло, добавляют H2SO4 и слегка упаривают до образования кромки у пятна. В присутствии ионов Ca2+ под микроскопом будут видны длинные игольчатые бесцветные кристаллы CaSO42H2O.
Для обнаружения катионов Ba2+ 2-3 капли этого же фильтрата помещают в пробирку, добавляют ацетатный буферный раствор (рН 5) и проводят реакции с гипсовой водой или с K2Cr2O7.
После завершения анализа следует оформить протокол и представить его на подпись преподавателю. В протоколе необходимо привести:
описание внешнего вида исследуемого раствора,
краткое описание хода анализа,
в случае положительного результата той или иной реакции - её уравнение.
В конце протокола необходимо сделать вывод о том, какие катионы найдены и какие не найдены в исследуемом растворе.
ЗАНЯТИЕ 3