
Глава 2. Расход тепла на нагрев металлов
Из курса физической химии известно, что в условиях данной температуры каждое вещество, находящееся в определённом состоянии, характеризуется постоянными величинами энтальпии (Н) и энтропии (S). Пря нагреве металлов происходит изменение их внутренней энергии вследствие изменения состояния электронов в атомах. Изменяется количество обобщенных коллективизированных электронов, что приводит к изменению кинетической энергии системы. Происходит изменение ряда термодинамических параметров и, в частности, изменяется анталышя (теплосодержание) системы.
В настоящее время нет способа расчёта абсолютного значения энтальпии, Поэтому в практических расчётах используется её изменение, происходящее при нагревании конкретного вещества.
При нагреве металлов изменение энтальпии на различных этапах процесса происходит по-разному Переход металла из одной модификации в другую или из одного агрегатного состояния в другое сопровождается скачкообразным изменением энтальпии (∆Н), Эти значения ∆Н постоянны для данного металла и могут быть взяты из таблиц, содержащих, термодинамические данные.
Если какой-то металл А имеет несколько модификаций в твёрдом состоянии (A1 и A2), то при его нагревании от температуры T1 (T1 < Тпл.) до температуры Т2 (Т2>Ткип.) весь процесс нагрева складывается из отдельных этапов:
Нагрев металла модификации A1 от температуры Т1 до температуры превращения (Тпр.) А1 →А2
Переход А1 ↔А2 при температуре Тпр., чему соответствует ∆Нпр. =const.
Нагрев металла модификации А2 от температуры Тпр. до температуры плавления
( Тпл.)
Переход твердого металла модификации A2 в расплавленное состояние
А2 ↔Аж при Тпл. чему соответствует ∆Нпл. =const.
Нагрев жидкого металла от Tпл.> до температуры кипения (Ткип.)
Переход жидкого металла Аж в парообразное состояние при Ткип, до температуры Т2.
Нагрев пара Апар. от температуры Ткип. до температуры Т2.
Температуры превращений (Тпр., Тл., Ткип.) и значения ∆Нпр., ∆Нпл., ∆Нкип. Для чистых металлов являються величинами постоянными и берутся в соответствующих таблицах. При этом следует отметить: ǀǀǀ переходе металла из твердого состояния в жидкое величина ∆Нпл.много больше любого из значений ∆Нпр. Особенно же резкое скачкообразное возрастание ∆Нпр наблюдается при переходе металла в газообразное состояние (∆Нкип) - велико .
Этот процесс в графическом изображении отражает все отдельные этапы (рис. 2.1)
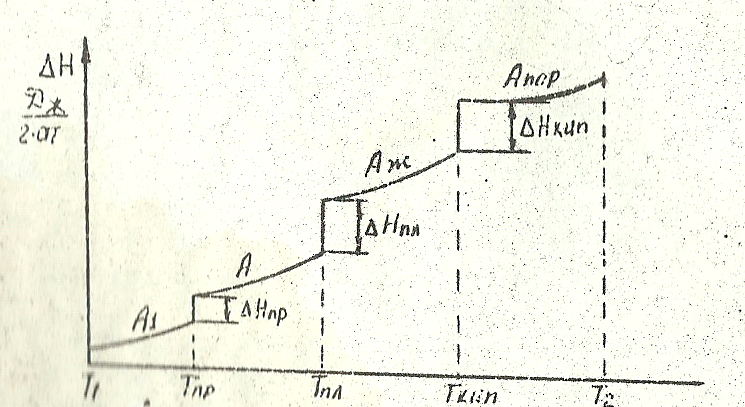
Рис. 2.1. Изменение энтальпии при нагреве металла
Расчет
изменения
![]() ∆Н
в интервалах температур (Т1-Тпр.),
(Тпр.-Тпл),(Тпл-Ткип), и (Ткип-Т2) осуществляется
через теплоемкости. Таким образом, общее
значение изменения теплосодержания
при нагреве металла А в интервале
температур Т1-Т2 можно рассчитать по
уравнению:
∆Н
в интервалах температур (Т1-Тпр.),
(Тпр.-Тпл),(Тпл-Ткип), и (Ткип-Т2) осуществляется
через теплоемкости. Таким образом, общее
значение изменения теплосодержания
при нагреве металла А в интервале
температур Т1-Т2 можно рассчитать по
уравнению:
∆Н=
![]() СрА1
хdT+∆Нпр
+
СрА1
хdT+∆Нпр
+![]() Срн2хdT+∆Нпл+
Срн2хdT+∆Нпл+![]() CрАжхdT+∆Нкип+
CрАжхdT+∆Нкип+![]() CрАпарХdT
CрАпарХdT
Значение
∆Н
выражается в Дж/гхатом
или кДж/гхатом.
Определив
изменение теплосодержания
одного
грамм-атома
вещества
/
или
одного моля/
можно рассчитать количество
тепла,
необходимого для нагрева
определенной весовой
единицы
металла (грамм
или килограмм),
разделив
полученное значение
∆К
на атомный или молекулярный вес:
∆h=![]() .Для
расчёта теплоёмкости используется
уравнение степенного
ряда
типа
.Для
расчёта теплоёмкости используется
уравнение степенного
ряда
типа
Ср= a+bT+cT2+…, где a, b, с – табличные коэффициенты для данного металла в данном интервале температур.
Контрольные вопросы
I. Какие термодинамичеоще параметры остаются постоянными, если металл находится в стационарных условиях (Т= const, p=const)?
2. Что характеризует энтальпия металла?
1. Что характеризует энтропия металла?
4. Что происходит в металле при его нагреве?
5. Как изменяется энтальпия при нагреве металла в интервале температур, когда никаких превращений в металле не происходит?
6. Как изменяется энтальпия при различных превращениях?
7. Как определить общее изменение энтальпии при нагреве металла в интервале температур, в котором имеют место различные превращения?
8. Какую следует использовать формулу для расчёта изменении энтальпии при ингреве алюминия (алотропные превращения отсутствуют) от 288 К до Тпл?
9. По какому уравнению можно определить изменение теплоемкости от температуры при постоянном давлении?
Пример расчета расхода тепла на нагрев металла.
Задача
Расочитыть расход тепла ни нагрев 1 кг железа от температуры 0°С до температуры 2727°С.
Решение
1. Из таблицы 5 находим:
Feα →Feβ при Тпр=1033°К ∆Нпр=2763 Дж/моль
Feβ→Feγ при Тпр=1184°К ∆Нпр=896 Дж/моль
Feγ→Feδ при Тпр=1665°К ∆Нпр=1185 Дж/моль
Feδ→Feж при Тпр=1812°К ∆Нпр=15282 Дж/моль
2. Составляем уравнение для расчета ∆Н.
∆Н=
![]() Ср
Feα
хdT+2763
+
Ср
Feα
хdT+2763
+![]() Ср
Feβ
хdT+896+
Ср
Feβ
хdT+896+![]() Cр
Feγ
хdT+1185+
Cр
Feγ
хdT+1185+![]() Cр
Feδ
ХdT+15282+
Cр
Feδ
ХdT+15282+
![]() Ср
Feж
хdT
Ср
Feж
хdT
3. Их таблицы 7 приложения находим хначения коэффициентов a, b, с для расчета теплоемкости по уравнению:
Ср=а+bT10-3+cT-2105
Feα a=17,49 b=24,79 с=0
Feβ a=37,66 b=0 с=0
Feγ a=7,70 b=19,5 с=0
Feδ a=43,93 b=0 с=0
Feж a=40,88 b=1,67 с=0
4.Подставляем значения Ср в уравнение для расчета ∆Н
∆Н=
![]() (17,49+24,79Т10-3)хdT+2763+
(17,49+24,79Т10-3)хdT+2763+![]() 37,66хdT+896+
37,66хdT+896+![]() (7,7+19,5Т10-3)хdT+1185+
43,93ХdT+15282+
(7,7+19,5Т10-3)хdT+1185+
43,93ХdT+15282+![]() (40,88+1,677х10-3)dT
(40,88+1,677х10-3)dT
5. Решая уравнение получаем:
∆Н=4941718,1 Дж=4941,7 кДж
В таблице 4 находим атомный вес железа (55,85) и определяем удельный расход тепла на нагрев 1кг железа от температуры 0°С до2727°С.
∆h=
=![]() =88740
Дж/г= 88,74 кДж/кг
=88740
Дж/г= 88,74 кДж/кг
