
Методические указания
к практическим занятиям
по дисциплине
«Теория металлургических процессов»
Авторы:
|
|
|
Бобрышев Б.Л., |
|
Серебряков В.В., |
|
Фадеева Г.Н. |
Введение
Цель практических занятий по курсу «Теория металлургических процессов» - закрепление лекционного материала и привитие студентам практических навыков определения основных термодинамических констант, позволяющих проводить анализ металлургических процессов и вероятность их протекания, а также выяснение факторов влияющих на ход того или иного процесса.
Темы практических занятий охватывают практически все основные разделы курса. Последовательность тематики практических занятий сообщается студентам преподавателем, читающим курс, на первой лекции.
К каждому очередному занятию студенты должны готовиться заранее, используя настоящее учебное пособие, лекционный материал и другую рекомендованную литературу.
Практические занятия проводятся погруппно. Каждое занятие включает в себя два этапа.
Первый этап состоит из проверки знаний студентов по теме занятия. Второй этап - непосредственное решение каждым студентом индивидуальной задачи, обработка полученных расчётом результатов и разработка по ним основных выводов по изучаемому процессу.
Оба этапа могут осуществляться или в аудитории с использованием микрокалькуляторов или в дисплейном классе с применением ЭВМ.
В первом случае порядок проведения занятий состоит в том, что студент, получив карточку для опроса, за 3-5 минут подготавливает ответе на вопросы, содержащиеся в карточке. Вопросы, включенные в карточку, охватывают основные определения, понятия, формулы и т.п. по изучаемому разделу. Эти вопроса приведены и в данном пособии. После выполнения первого этапа и получения положительных результатов, студент знакомится с задачей, составляет план расчёта, выделяет этапы решения, используя данные прилагаемых таблиц, составляет уравнение, необходимое для решения задачи, а затем решает его с использованием заданных значений. По расчетным данным составляется сводная таблица, строится график, проводится анализ изучаемого процесса и делается вывод.
Следует иметь ввиду, что при всех термодинамических расчетах температура в расчетные уравнения ставится в градусах Кельвина.
Ниже приводятся примеры решения задач по всем темам практических занятий.
При проведении практических занятий в дисплейклассе студент общается с ЭВМ в диалоговом режиме. После включения лаборантом ЭВМ и загрузки в неё рабочей программы, студент вводит в ЭВМ номер темы текущего занятия. Затем студенту предлагается несколько вопросов, число которых устанавливается преподавателем, с вариантами ответов, один из которых является верным. При введении номера ответа, считаемого студентом верным, ЭВМ автоматически задает ему следующий вопрос. Если введённый ответ не верен, ЭВМ в конце опроса отмечает неверные ответы, приводит объяснения ошибок и список литературы, в которой можно получить необходимые сведения по данному вопросу.
В случае, если число неверных ответов значительно, студенту ставится неудовлетворительная оценка и он не допускается к занятиям.
Если число неверных ответов незначительно, студенту либо предлагается ещё несколько вопросов, либо он допускается к практическим занятиям. Количество возможных неверных ответов может быть установлено преподавателем конкретно для каждого студента.
По окончании опроса ЭВМ предлагает студенту задачу по изучаемой теме. При этом она предлагает также и несколько путей решения этой задачи различными способами. После выбора студентом какого-то пути решения ЭВМ последовательно предлагает ему формулы для решения задачи. Студент сам выбирает необходимые формулы для решения и вводит их в ЭВМ.
После решения задачи по формулам, предложенным студентам, ЭВМ выводит на дисплей или печатающее устройство весь ход решения задачи с цифровыми данными и ответ, полученный при этом. Здесь же приводится и правильный ответ данной задачи, в случае, если имеется разница между этими ответами, студенту предоставляется возможность повторного решения этой же задачи. После этого ЭВМ построчно выводит ход решения задачи студентом и рядом ход: поэтапного решения задачи.
Если разница в ответах всё же осталась и после повторного решения, но вызвана незначительными ошибками, студенту может быть поставлена удовлетворительная оценка Если причина более серьёзная, студенту предлагается ещё одна задача, решение которой определяет оценку, получаемую студентом. Общая оценка складывается из оценки за опрос перед занятием и за решение задачи.
Глава 1 свободной энергии
Для изучения -металлургических реакций большое значение
представляет физико-химический анализ сложных гетерогенных
систем, в которых может происходить ряд элементарных процессов: физических (нагрев, плавление, испарение, конденсация и др.), химических (окисление, раскисление, образование нитридов, гидридов и др.) и физико-химических (адсорбция, диффузия, абсорбция).
Термохимические расчеты, производимые для целей анализа металлургических процессов, обычно сводятся к определению константы равновесия (Кр) при данных условиях. Однако в таблицах вместо константы равновесия обычно указывается функция ∆G, представляющая изменение свободной энергии, связанная с
константой равновесия процесса уравнением Вант-Гоффа:
![]()
![]() (1.1)
(1.1)
Свободная энергия - это та часть внутренней анергии системы, за счёт которой совершается работа при изотермическом процессе. У системы, находящейся в равновесии, свободная энергия минимальна. Если процесс сопровождается уменьшением свободной энергии, то это говорит о возможности данного процесса. Повышение свободной энергии, полученное расчетом, показывает на невозможность протекания процесса в данном направлении.
Это объясняется тем, что всякая система стремиться к более устойчивому состоянию, которому соответствует минимальная свободная энергия. Следовательно, умение рассчитать изменение свободной энергии дает даёт возможность установить вероятность протекания интересующего процесса в данном направлении.
Основой для расчёта изменения свободной энергии может служить уравнение Гиббса-Гельмгольца:
![]() (1.2)
(1.2)
Где
![]() -
изменение свободной энергии при
интересующей нас температуре Т и
нормальном давлении, Дж;
-
изменение свободной энергии при
интересующей нас температуре Т и
нормальном давлении, Дж;
![]() - изменение энтальпии при температуре
Т и нормальном давлении, Дж/моль;
- изменение энтальпии при температуре
Т и нормальном давлении, Дж/моль;
![]() - изменение энтропии при температуре Т
и нормальном давлении, равном 10 мПа,
Дж/,К·моль;
- изменение энтропии при температуре Т
и нормальном давлении, равном 10 мПа,
Дж/,К·моль;
![]() (1.3)
(1.3)
![]() (1.4)
(1.4)
![]() - изменение энтальпии в стандартных
условиях;
- изменение энтальпии в стандартных
условиях;
![]() -
изменение
энтальпии в стандартных условиях.
-
изменение
энтальпии в стандартных условиях.
Значение этих величин приводятся в таблицах.
![]() -
изменение атомной или молярной
теплоёмкости при постоянном давлении,
Дж/моль·K.
-
изменение атомной или молярной
теплоёмкости при постоянном давлении,
Дж/моль·K.
Согласно уравнению Кирхгофа
![]() ,
(1.5)
,
(1.5)
Где a; b; c – табличные коэффициенты.
Общий вид преобразованного уравнения:
 (1.6)
(1.6)
Уравнение весьма громоздко, но позволяет производить расчет, используя табличные данные термодинамических коэффициентов для стандартных условий. В том случае, если таких данных недостаточно, можно использовать приближенный метод расчета. В основу приближенного метода заложено допущение:
![]() ;
;
![]() .
.
В результате получается упрощенное уравнение вида:
![]() ;
(1.7)
;
(1.7)
![]() .
(1.8)
.
(1.8)
Вычитая уравнение (1.8) из уравнения (1.7), получим уравнение (1.9):
![]() .
(1.9)
.
(1.9)
Учитывая принятые допущения, можно записать последнее уравнение в виде
. (1.10)
В последнее время для упрощения расчетов разработан ряд методов с использованием табличных коэффициентов. Такие коэффициенты рассчитаны для большинства наиболее распространенных реакций, в которых участвуют простые вещества. Одним из таких уравнений является уравнение вида
![]() ,
(1.11)
,
(1.11)
Где A, B, C, Д – табличные величины, указанные для конкретных уравнений и определенного интервала температура.
Коэффициент Д, ввиду его малой значимости, часто не учитывается при расчетах.
В таблицах приводятся значения коэффициентов для реакции, в которых участвуют чистые вещества. Если же в реакции участвуют не только чистые вещества, но и соединения, можно использовать косвенный метод расчета.
Например, нас интересует изменение свободной энергии процесса окисления железа водяным паром.
1)
Fe+H2O=FeO+H2
![]() =?
=?
Поскольку в процессе участвуют H2O и FeO , в не только чистые компоненты, данных для расчета в таблице может не быть. В этом случае интересующую нас реакцию следует разделять на ряд реакций, в них будут участвовать простые вещества. Изменение свободной энергии можно рассчитать:
2)
![]() ,
,
![]()
3)
![]() ,
,
![]()
Вычитая из 2-й реакции 3-ю, получим первую реакцию:
1)
![]()
Или
![]()
Следовательно и изменение свободной энергии может быть найдено через разность:
![]()
Расчет и анализ изменения термодинамических констант являются составной частью термодинамического анализа, который позволяет установить вероятность протекания данного процесса, но не говорит о его пути и скорости. Для ответа на вопросы, объясняющие через какие стадии проходит процесс и с какой скоростью, следует использовать данные кинетического анализа.
Контрольные вопросы
Каким путем осуществляется термодинамический анализ?
Какое уравнение связывает константу равновесия реакции с изменением свободной энергии?
Что такое свободная энергия?
Какое значение имеет свободная энергия у системы находящейся в состоянии равновесия?
В каком направлении будет протекать процесс, если он сопровождается уменьшением свободной энергии?
В каком направлении будет протекать процесс, если он в записанном виде уравнения сопровождается увеличением свободной энергии?
Что характеризует изменение энтальпии при протекании процесса?
Что означает изменение энтропии при протекании процесса?
По какому уравнению можно рассчитать изменение свободной энергии (
 )
с использованием значений
)
с использованием значений
 и
и
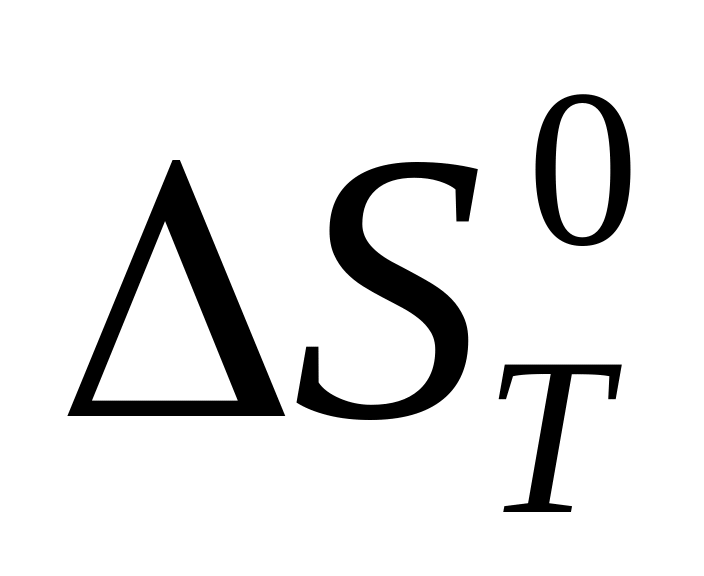 при заданной температуре Т?
при заданной температуре Т?Как рассчитать изменение свободной энергии, если известны значения
 и
и

Что такое атомная или молярная теплоемкость?
По какому уравнению можно рассчитать изменение теплоемкости
 ?
?Какие допущения заложены в приближенный метод расчета изменения свободной энергии?
Какой вид имеет уравнение для приближенного расчета изменения свободной энергии?
Какой вид имеет уравнение для расчета изменения свободной энергии с использованием табличных коэффициентов А, В, С, Д?
Для какой цели используются косвенный метод расчета изменения свободной энергии?
В чем состоит косвенный метод расчета изменения свободной энергии?
На какие вопросы дает ответ термодинамический анализ?
Пример расчета изменения свободной энергии
Задача
Рассчитать
изменение свободной энергии при
образовании кремнезема (SiO2)
для температур 500°С, 827°С, 1127°С, 1400°С,
1500°С и 1600°С из расчета на один моль
кислорода. По полученным данным построить
график
![]() и провести анализ процесса.
и провести анализ процесса.
Решение задач
1.В
таблице 6 приложения находим, что для
реакции образования кремнезема Si+O2=SiO2
при температурах Т1,
Т2,
Т3
и Т4
коэффициенты
для уравнения
![]() имеют следующие значения:
имеют следующие значения:
А=-902670; В=0; С=-173,8,
а для температур Т5 и Т6
А=-872110; В=-12,56; С=-204,27.
2. Подставляя соответствующие значения коэффициентов, рассчитываем значения
T1=773°С
![]()
T2=1100K
![]()
T3=1400K
![]()
T4=1673K
![]()
T5=1773K
![]()
T6=1873K
![]()
3. Полученные данные сводим в таблицу 1.1.
Таблица 1.1 |
||||||
Температура, К |
773 |
1100 |
1400 |
1673 |
1773 |
1873 |
,кДж |
-768,3 |
-711,5 |
-659,4 |
-611,9 |
-582,3 |
-566,5 |
4. По расчетным данным строим график (рис.1.1).
|
Рис.1.1. Изменение свободной энергии реакции образования кремнезёма в зависимости от температуры |
5.Вывод. С повышением температуры расход свободной энергии на процесс уменьшается, следовательно реакция образования кремнезема более вероятна при относительно низких температурах.

