
- •Заняття № 6 Тема: Ретровіруси. Лабораторна діагностика
- •Опортуністичні інфекції.
- •Теоретичні питання:
- •Методика проведення практичного заняття
- •Технологічна карта практичного заняття
- •Практична робота студентів
- •Методичні рекомендації по виконанню практичної роботи Робота 1
- •Приклади тестових завдань:
- •8. Репродукція яких вірусів включає обов‘язкову інтеграцію у геном клітини-хазяїна
- •9. При обстеженні молодого чоловіка у центрі по боротьбі зі сніДом отриманий позитивний результат іфа з антигеном віл. Скарги на стан здоров‘я відсутні. Про може свідчити позитивний результат іфа?
- •Додаток б
- •Графи логічної структури на тему:
- •Гени hiv-1 та їх продукти
- •1 Етап. Скринінгові методи дослідження іфа
- •2 Етап. Референтне дослідження іфа
- •3 Етап. Експертне дослідження (імуноблотинг, іфа, плр, днк-зондування)
Методика проведення практичного заняття
На початку заняття за допомогою тестових завдань викладач перевіряє рівень знань-умінь кожного студента. Потім викладач методом опитування та заповнення карти програмового контролю з‘ясовує ступінь та глибину засвоєння кожним студентом теоретичного матеріалу. Наступний етап роботи – засвоєння студентами методики виконання практичної роботи. Після цього студенти виконують практичну роботу, хід виконання якої контролюється викладачем. При вивченні студентами демонстрацій проводиться їх аналіз, робляться висновки, які заносяться у протокол практичного заняття.
Технологічна карта практичного заняття
Етапи роботи |
Години, хвилини |
Навчальні посібники |
Місце проведення |
1. Тестовий контроль початкового рівня знань |
10 |
Тести |
Комп‘ютерна кімната |
2. Опитування студентів по основним питанням теми. |
10 |
Таблиці, схеми |
Кімната для практичних занять
|
3. Заповнення карт програмованого контролю. |
15 |
|
|
4. Виконання практичної частини заняття. |
40 |
Схеми "Мікробіологічна діагностика ВІЛ-інфеції", "Діагностика Т-клітинного лейкозу", „Принцип ІФА”, тест-системи ІФА, діагностичні, лікувально-профілактичні препарати, слайди. |
|
5. Підведення підсумків заняття. |
5 |
Таблиці, схеми |
Практична робота студентів
Вивчити і врахувати результати виявлення антитіл проти gp120 ВІЛ в досліджуваних сиворотках методом ІФА (демонстрація). Написати висновок.
Оцінити результати серологічної діагностики ВІЛ-інфекції (імуноблотинг). Зробити висновок.
Ознайомитись з програмованим термостатом, який використовується для проведення ПЛР. Записати схему реакції.
Оцінити результати вивчення імунного статуса осіб з підозрою на СНІД (демонстрація ). Написати висновок.
Препарати, які використовуються для лікування хворих СНІДом.
Малюнки, схеми, таблиці.
Методичні рекомендації по виконанню практичної роботи Робота 1
Серед різноманітних реакцій, що використовуються для серодіагностики ВІЛ-інфекції, найбільш розповсюдженою є ІФА. В ній виявляють специфічні антитіла в сироватці крові хворого. Для постановки ІФА на виявлення антитіл проти gp120 ВІЛ використовується тест система, яка включає антигени, що виділені з інфекованих культур клітин або отриманні за допомогою рекомбінантних ДНК.
Сутність цієї ріеакції полягає в тому, що на дні полістиролових планшетів таких наборів адсорбований вірусний антиген - gp120, який отримується за допомогою генноінженерної технології. При додаванні в комірки досліджуваної сиворотки, що містить антитіла до цього антигену, утворюється імунний комплекс. Утворений комплекс антиген-антитіло (АГ-АТ) відмивається від вільних антитіл, після чого в комірки додається антивидова (антилюдська) сиворотка, кон’югована з пероксидазою хрону. При додаванні субстрата (окису водню) і індикатора (діамінобензидина) розвивається коричневе забарвлення (внаслідок зміни рН під час розщеплення субстрату), інтенсивність якого пропорціональна кількості антитіл. Оптична густина реєструється в багатоканальних спектрофотометрах.
Слід зауважити, що анти-gp120 антитіла з’являються через 2 – 8 тижнів після інфікування. Оскільки ІФА дає 25 – 30% псевдопозитивних результатів, всі зразки сиворотки крові, які дали позитивну відповідь, обов’язково піддаються на другому етапі, перевірці на наявність в сиворотці антигенів віруса. Ця реакція називається імуноблотинг.
Студент повинен зробити оцінку реакції на основі знань про механізм даної реакції, зарисувати її у протоклі та написати висновок. У висновку студент має вказати у якого з досліджуваних людей діагноз підтверджується і чому?
Робота 2
Для підтвердження діагнозу „ВІЛ-інфекція”, на заключному етапі серодіагностики, використовуються експертні методи. Один з таких методів – імуноблотинг. В ході імуноблотингу визначається наявність корового антигена віруса - р24 за допомогою стандартної моноклональної (рідше моноспецифічної) анти-р24 сиворотки. Принцип цього метода полягає у наступному: з крові хворого виділяють лімфоцити, білки яких піддають електрофорезу в поліакриламідному гелі. Потім білки переносять на нітроцелюлозну чи нейлонову мембрану, яку інкубують з моноклональними анти-р24 антитілами. Після видалення незв’язаних антитіл мембрану обробляють антивидовою (антимишиною) сивороткою, яка кон’югована з пероксидазою хрону. Далі імунні комплекси реєструють, як звичайно, за виявленням забарвлення.
Існує і інший варіант імуноблотинга, розрахований на виявлення анти-р24 антитіл в сиворотці людини. В цьому випадку піддають електрофорезу і переносять на мембрану стандартний вірусний антиген (чи цілий препарат інактивованого віруса). Далі фільтр обробляють досліджуваною сивороткою, а потім антилюдською сивороткою, міченою пероксидазою хрону. Результат оцінюють за забарвленням (дивись малюнок).
електрофорез в
гелі антигенів збудника
Перенос АГ на папір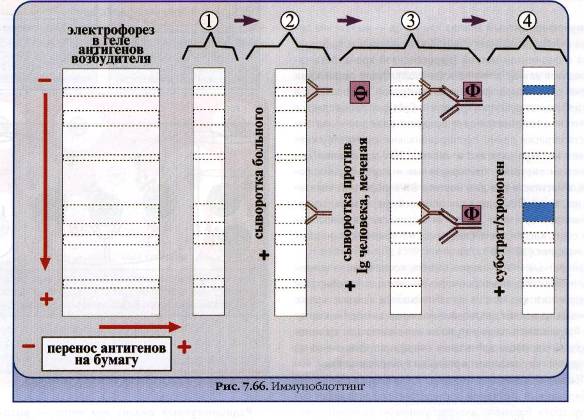

Оцінка результатів імуноблотингу проводиться суворо за інструкцією, яка додається до тест-системи. У випадку відсутності в інструкції вказівок для інтерпретації результатів, треба користуватися інструкцією ВОЗ (табл. 1)
Табл. 1 Критерії інтерпретації результатів імуноблотинга для ВІЛ-1 та ВІЛ-2 (ВОЗ, 1990)
Результат |
ВІЛ-1 |
ВІЛ-2 |
Позитивний
Негативний
Сумнівний
|
2 полоски env +/- полоски pol +/- полоски gag Відсутність ВІЛ-1 специфічних полосок Інші профелі, що не розглядаються як позитивні чи негативні |
2 полоски env +/- полоски pol +/- полоски gag Відсутність ВІЛ-1 специфічних полосок Інші профелі, що не розглядаються як позитивні чи негативні |
Студент повинен зробити оцінку реакції на основі знань про механізм даної реакції, зарисувати її у протоклі та написати висновок. У висновку студент має вказати у якого з досліджуваних людей діагноз підтверджується і чому?
Робота 3
В останні роки згідно рекомендаціям ВООЗ всі нативні донорські матеріали повинні бути протестовані на ВІЛ за допомогою ПЛР. Об’єктом дослідження ПЛР можуть бути любі нативні матеріали, отримані від людини.
Принцип метода полягає в ампліфікації нуклеотидних послідовностей, які досліджують, при участі термофільної ДНК-полімерази.
Реакція проводиться в 3 етапи.
На першому етапі матеріал (клітина чи ізольована клітинна ДНК ) піддається термічній денатурації при 95ºС для поділу двохспіральної ДНК на однонитчасті молекули.
На другому етапі короткі олігонуклеотидні послідовності (затравки, праймери) гібридизуються з комплементарними послідовностями, фланкіруючими невеликий фрагмент ДНК.
На третьому етапі (елонгації) термофільна ДНК-полімераза добудовує ампліфікований фрагмент.
Зазвичай проводять 30 – 40 циклів ампліфікації, що дозволяє розмножити визначальний фрагмент в 106 разів. Далі продукт реакції піддають електрофорезу в агаразному гелі і порівнюють розмір отриманого фрагмента з очікуванням. У випадку необхідності переносять цей продукт на мембранний фільтр і гібридизують із специфічним зондом.
ПЛР дозволяє виявити одну копію вірусного геному в 105 – 106 клітинах через 24 год. після інфікування.
Студент повинен зробити оцінку реакції на основі знань про механізм даної реакції, зарисувати її схему у протоклі та написати висновок.
Робота 4
Студент повинен в ситуаційній задачі з імунограмою, яка проведена в динаміці, визначити наявність вторинного імунодефіциту.
Нагадаємо план імуно-лабораторного обстеження:
Загальний аналіз крові, ШОЕ, С-реактивний білок.
Оцінка клітинної (Т-ланки ) імунітету:
а) кількість популяцій та субпопуляцій Т-лімфоцитів (CD2, CD3, CD4, CD8); співвідношення CD4+/CD8+клітин;
б) шкіряні тести з т.н. reccall-антигенами (правцевий та дифтерійний токсини, туберкулін, кандіда, трихофітон);
в) проліферативна активність в РБТ с ФГА, Кон А.
3. Оцінка гуморального (В-ланки) імунітета:
а) кількість В-лімфоцітив (CD19, CD20, CD23);
б) рівень сироваткових IgM, IgG, IgA, IgE, секреторного IgA.
4. Оцінка системи фагоцитів:
а) кількість фагоцитуючих нейтрофілів та моноцитів;
б) активність фагоцитозу;
в)кисень-залежний метаболізм за НСТ-тестом.
5. Оцінка системи комплементу:
а) визначення кількості С3;
б) визначення кількості С4;
в) визначення кількості загального комплементу за СН50.
При необхідності блш глибокого вивчення імунного стутусу визанчають:
Кількість та функцію ЕК-клітин (CD16/CD56);
HLA-фенотип;
Продуктцію прозапальних цитокінів (ІЛ-2, ІНФγ, ФНПα, ІЛ-8, ІЛ-12);
Продукцію протизапальних цитокінів (ІЛ-4, ІЛ-5, ІЛ-10, ІЛ-13);
Наявність специфічних аутоантитіл;
Наявність специфічної клітинної сенсибілізації;
Наявність Т- та В-клітин з ознаками активації (DR, CD25, CD71).
Рекомендації, якими необхідно користуватися при інтерпретації імунограм (К.А. Лєбєдєв):
Повноцінну інформацію можна отримати, проводячи аналіз імунограми в комплексі з оцінкою клінічної картини у даного пацієнта.
Комплексний аналіз імунограм більш інформативний, ніж оцінка кожного показника окремо.
Реальну інформацію в імунограмі несуть тільки стійки виражені зсуви показників.
Аналіз імунограми в динаміці більш інформативний як в діагностичному, так і в прогностичному відношенні, ніж одноразово отримана іімунограма.
В більшості випадків аналіз тільки однієї мінограми дає можливість зробити лише орієнтировачні, а не безумовні висновки діагностичного та прогностичного характера.
Відсутність зсувів імунограми при наявності клінічної картини запального процесу повинно трактуватися як атипова реакція імунної системи і є погіршуючою ознакою перебігу процесу.
Імунологічні показники |
Показник |
Норма |
|
1 обстеження
|
2 обстеження
|
||
Абсолютна кількість лейкоцитів (г/л) |
|
|
4 – 8 |
Абсолютна кількість лімфоцитів (г/л) |
|
|
800 – 3600 |
% лимфоцитів |
|
|
19 – 37 |
Т-лімфоцити |
|
|
|
- абс. |
|
|
600 – 1600 |
- % |
|
|
40 – 60 |
Т-хелпери |
|
|
|
- абс. |
|
|
400 – 1500 |
- % |
|
|
30 – 40 |
Т-супресори/цитотоксичні |
|
|
|
- абс. |
|
|
120 – 450 |
- % |
|
|
10 – 19 |
ІРІ (Т-хелпери/Т-супресори) |
|
|
2,2 – 3,2 |
В-лімфоцити |
|
|
|
- абс. |
|
|
300 – 450 |
- % |
|
|
15 – 30 |
Імунолглобуліни (г/л) |
|
|
|
- G |
|
|
7 – 20 |
- A |
|
|
0,7 – 5,0 |
- M |
|
|
0,5 – 2,0 |
Імунні коплекси |
|
|
0,04 – 0,09 опт.щільн. |
Фагоцитарний індекс |
|
|
40 – 70 |
Фагоцитарне число |
|
|
2 – 8 |
Слід зауважити, що у більшості осіб ВІЛ викликає сильну імунну відповідь. Масивна реплікація ВІЛ після зараження супроводжується наростанням цитотоксичної клітинної імунної відповіді, при чому відсоток цитотоксичних лімфоцитів, які розпізнають пептиди ВІЛ, може досягати 1% всіх лімфоцитів. Однак після періоду експансії велика частина специфічних щодо ВІЛ Т-кілерів зникає.
На початковому періоду хвороби у крові накопичується антитіла: спочатку IgM, специфічні до білків р24 та gp41. Максимальної концентрації вони досягають через 2 - 5 тижнів, а потім ця концентрація знижується до рівня, який не піддається виявленню протягом трьох місяців. У середньому через кілька тижнів у сироватці спостерігається високий рівень антитіл IgG, які розпізнають білки p24, gp41 та gp120.
Одночасно має місце падіння числа Т-лімфоцитів (у безумовних величинах і стосовно до СД8+-лімфоцитів ). Спочатку їх рівень повертається до норми, але потім по ходу розвитку хвороби знов знижається. Критичною величиною вважається рівень 200 лімфоцитів СД4+ в мл (норма становить 800-1200/мл), і зниження нижче цієї величини у ВІЛ-інфікованої особи тепер вважають достатнім критерієм для діагностики повного симптомокомплексу СНІД.
Робота 5
Вивчіть анотації, розгляньте препатати, заповніть протоколи.
Протокол 5. Препарати для терапії ВІЛ-інфекції.
Назва препарату |
Склад |
Показання для використання |
АНОТАЦІЇ
до лікувальних препаратів до теми:: „Ретровіруси. Лабораторна діагностика ВІЛ-інфекції (СНІДу) та Т-клітинного лейкозу. Опортуністичні інфекції”.
А2Т - азидотимідин (зідовудін), використовується для лікування заражених вірусом ВІЛ людей, гальмує зворотну транскрипцію вірусу і належить до групи аналогів нуклеозидів. Тимчасово підіймає рівень Т-лімфоцитів.
ddC (залцитабін), ddJ (діданозин), 3TC (ламівудин), D4Tставудин, використовуються для лікування заражених вірусом ВІЛ людей. Ці перепарти відносяться до групи аналогів нуклеозидів, вони пригнічують синтез провірусної ДНК, підставляючись як фальшиві основи і блокуючи активність фермента.
„Сакінавір”, „Рітонавір”, „”Індінавір”, „Нелфінавір” – препарати, які використовуються длі лікування ВІЛ-інфікованих, що відносяться до групи інгібіторів вірусної протеази. Використання таких препаратів знижує кількість генетичного матеріалу ВІЛ у лімфоїдних органах та покращує параметри імунної системи та клінічний стан хворих.
ДЕМОНСТРАЦІЯ
Схема розвитку ВІЛ-інфекції
Антитіла
CD8
Т-клітини
CD4
Т-клітини
ВІЛ у плазмі
Грипо-подібний
стан
4
– 8 тижнів
Асимптоматична
фаза
2
– 12 років
Симпто-матична
фаза
2
– 3 років
Смерть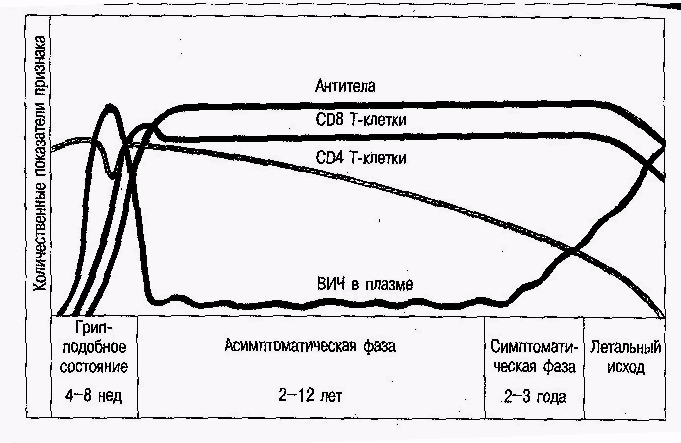
ВІЛ відноситься родини лентівірусів, що входять до родини ретровірусів. Більшість ретровірусів викликає некотролюємий клітин господаря. В той же час патогенетична дія лентівірусів проявляється у вигляді руйнування клітин, які вони інфікують. Розвиток ВІЛ-інфекції починається відразу після проникнення вірусу в організм людини. Інфікування відбувається через сперму, вагінальну рідину, кров хворго в результаті його контакту зі здоровими людьми. ВІЛ інфікує переважно СД4 Т-клітини та макрофаги.
В перший період розвитку інфекції, що позначається як етап грипозоподібного стану, відбувається „спалах” розмноження вірусу, що реєструється за чисельністю віріонів у крові. Збільшення кількості вірусних часток є симптоматичною ознакою захворювання. В той же період спостерігається зниження числа СД4 Т-клітин у периферичній крові: приблизно з 1000 до 600 клітин на 1 мл. Через 4 – 8 тижнів від момента інфікування починається другий етап – асимптоматична фаза ВІЛ-інфекції. В цей період мобілізуються імунні механізми захисту: накопичуються антитіла до вірусних білків і збільшується кількість специфічних до вірусу СД8 Т-клітин. Вірус в асимптоматичний період практично повністю зникає з крові, а кількість СД4 Т-клітин на початку періоду повертається до норми. Аде відсутній у крові вірус мобілізується на поверхні дендритних клітин у вигляді комплекса з антитілами. Звідси він проникає у інактивні СД4 Т-клітини, що оточують первинні та вторинні фолікули.
Саме фолікули лімфоїдної тканини є основним методом підтримання інфекції, а сформована імунна відповідь не в стані запобігати ефективному накопиченню вірусів. У симптоматичний період відбувається сниження кількості СД4 Т-клітин і екпонтеціальне накопичення вірусу у крові. Процес розмноження вірусів, що „вирвався” з під контролю імунної системи, призводить до повного виснаження лімфоїдної тканини, виникненню супутніх інфекцій і в результаті до летального ісходу.
