
- •Аннотация
- •Оглавление
- •Начальные данные
- •Термодинамическая оценка окисляемости металлов при термообработке оксидного катода.
- •Первое приближение
- •Второе приближение
- •Третье приближение
- •Расчет окисляемости металлов
- •Диффузионное легирование полупроводников
- •Начальные данные
- •Температурная зависимость коэффициента диффузии
- •Расчет профиля легирующей примеси для каждого этапа диффузии
-
Первое приближение
В условиях первого приближения пренебрегается температурной зависимостью термодинамических величин, т.е. полагается, что СР = 0. Тогда (1.9) принимает вид:
 (1.16)
(1.16)
Для определения
 и
и
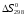 используем выражения (1.12)
и (1.13)
используем выражения (1.12)
и (1.13)
Для определения
 и
и
 воспользуемся формулой (1.6)
воспользуемся формулой (1.6)





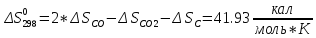
 ;
;
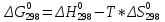
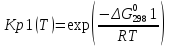 ;
;

 ;
;
 ;
;


Рисунок 1 - Температурные зависимости парциальных давлений СО и СО2

Рисунок 2 - Температурная
зависимость
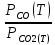
-
Второе приближение
Пренебрегаем температурной зависимостью теплоемкостей, т.е. полагаем T=298 K, ср(Т) ср(298) const, тогда из (1.9), (1.10) и (1.11) следует:
 , (1.17)
, (1.17)
где
 ,
,
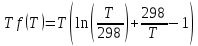 ,
названная функцией Улиха относительно
температуры Т.
,
названная функцией Улиха относительно
температуры Т.
Для определения
 и
и
 воспользуемся формулой (1.6)
воспользуемся формулой (1.6)
.





 ;
;

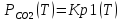 ;
;
 ;
;


Рисунок 3 - Температурные зависимости парциальных давлений СО и СО2

Рисунок 4 - Температурная
зависимость

-
Третье приближение
Третье приближение является наиболее полным и учитывает точную температурную зависимость Δср(Т), рассчитанную по формуле (1.14) на основе табличных данных. В этом приближении используют формулу Темкина– Шварцмана:

где Δa, Δb, Δc – алгебраические суммы коэффициентов (1.15), найденные с учетом стехиометрических коэффициентов реакции (1.7) по общему правилу:
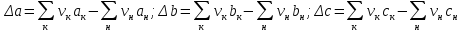
Для определения
 и
и
 воспользуемся формулой (1.6)
воспользуемся формулой (1.6)






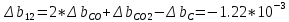






 ;
;

 ;
;
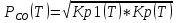

Рисунок 5 - Температурные зависимости парциальных давлений СО и СО2

Рисунок 6 - Температурная
зависимость

-
Расчет констант равновесия для MgCO3↔MgO+CO2 и CO2+C↔2CO

Расчет сделаем в первом приближении. Формулы нахождения энтальпии, энтропии, констант равновесия и давлений аналогичны тем, которые мы использовали для реакции SrCO3↔SrO+CO2.

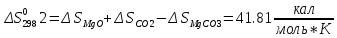
 ;
;
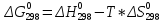
 ;
;

 ;
;
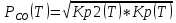 ;
;
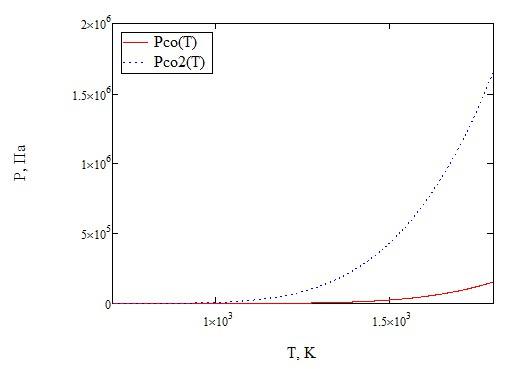
Рисунок 7 - Температурные зависимости парциальных давлений СО и СО2

Рисунок 8 - Температурная
зависимость

-
Расчет констант равновесия для CaCO3↔CaO+CO2 и CO2+C↔2CO
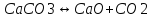
Расчет сделаем в первом приближении. Формулы нахождения энтальпии, энтропии, констант равновесия и давлений аналогичны тем, которые мы использовали для реакции SrCO3↔SrO+CO2.


 ;
;

 ;
;

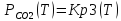 ;
;
 ;
;


Рисунок 9 - Температурные зависимости парциальных давлений СО и СО2

Рисунок 10 - Температурная
зависимость

-
Расчет окисляемости металлов

Расчет сделаем в первом приближении. Формулы нахождения энтальпии, энтропии, констант равновесия и давлений аналогичны тем, которые мы использовали для реакции SrCO3↔SrO+CO2.


 ;
;

Вычислим энергию Гиббса и оценим окисляемость металла, учитывая, что керн покрыт CaO(65%)+MgO(10%)+SrO(25%). Для этого воспользуемся уравнением изотермы Вант-Гоффа:
 ;
(1.19)
;
(1.19)
где
pсо/pСО2
– отношение давлений, полученное из
расчета газовой фазы, отличающееся от
соотношения равновесных величин
 .
.



Рисунок 11 - Изобарный потенциал реакции в реальных условиях
Вывод: Из (1.19) видно, что:
а)
при >
> имеем G
> 0, т.е. реакция
имеем G
> 0, т.е. реакция
 сдвинута влево и соответствующий металл
не окисляется в данной газовой смеси;
сдвинута влево и соответствующий металл
не окисляется в данной газовой смеси;
б)
при
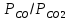 <
< имеем G
< 0, т.е. реакция сдвинута вправо и металл
окисляется.
имеем G
< 0, т.е. реакция сдвинута вправо и металл
окисляется.
В нашем случае на интервале 700…1800 К мы имеем ΔG < 0 (рис.11), т.е. реакция сдвинута вправо и металл окисляется.
