
- •Аннотация
- •Оглавление
- •Начальные данные
- •Термодинамическая оценка окисляемости металлов при термообработке оксидного катода.
- •Первое приближение
- •Второе приближение
- •Третье приближение
- •Расчет окисляемости металлов
- •Диффузионное легирование полупроводников
- •Начальные данные
- •Температурная зависимость коэффициента диффузии
- •Расчет профиля легирующей примеси для каждого этапа диффузии
МИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра ФЭТ
Курсовая работа
по дисциплине «ФХОТ изделий электроники и наноэлектроники»
Тема: РАСЧЕТ ГАЗОТРАНСПОРТНЫХ
И ДИФФУЗИОННЫХ ПРОЦЕССОВ В ТЕХНОЛОГИИ
ЭЛЕКТРОННЫХ ПРИБОРОВ
Вариант 15
|
Студент гр. 5207 |
|
Иванов А.Д. |
|
Преподаватель |
|
Медведева Н.Ю. |
Санкт-Петербург
2017
Аннотация
В первой части работы необходимо определить, будут ли окисляться металлы при термообработке оксидного катода в температурном интервале 700-1800 К. Для этого вычислим энергию Гиббса и оценим окисляемость металла, учитывая, что катод покрыт CaO(65%)+MgO(10%)+SrO(25%).
Во второй части работы мы будем исследовать глубину залегания примеси. Для этого на графиках найдем точки пересечения исходной концентрации примеси с концентрацией примеси на этапе разгонки.
Summary
In the first part of the work it is necessary to determine whether metals will oxidize during the heat treatment of the oxide cathode in the temperature range 700-1800 K. To do this, we calculate the Gibbs energy and estimate the oxidability of the metal, taking into account that the core is covered with CaO (65%) + MgO (10%) + SrO (25%).
In the second part of the work we will investigate the depth of the impurity. To do this on the graphs we find the points of intersection of the initial impurity concentration with the impurity concentration at the stage of distillation.
Оглавление
АННОТАЦИЯ 2
Начальные данные 4
1.Термодинамическая оценка окисляемости металлов при термообработке оксидного катода. 8
1.1Расчет констант равновесия для SrCO3↔SrO+CO2 и CO2+C↔2CO 12
1.1.1Первое приближение 12
1.1.2Второе приближение 15
1.1.3Третье приближение 17
1.2Расчет констант равновесия для MgCO3↔MgO+CO2 и CO2+C↔2CO 20
1.3Расчет констант равновесия для CaCO3↔CaO+CO2 и CO2+C↔2CO 21
1.4Расчет окисляемости металлов 24
2.Диффузионное легирование полупроводников 26
Начальные данные 27
2.1Температурная зависимость коэффициента диффузии 28
2.2Расчет профиля легирующей примеси для каждого этапа диффузии 29
Начальные данные
Таблица 1 - Термодинамические свойства металлов и соединений.
Вещество
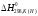
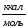
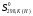
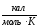
СP,
298,
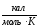
СР(Т) = а + bT + cT2
a
b*103
c*10-5
SrCO3
291,7
23,1
19,4
18,8
12,7
2,2
SrO
141,7
13,1
10,7
11,5
2,1
1,0
C
0
1,4
2,04,1
1,0
2,1
CO (газ)
26,4
47,1
7,06,8
1,0
0,1
CO2 (газ)
94,1
51,1
8,910,6
2,2
2,0
Mg
0
7,81
5,9
MgO
143,2
6,4
8,8
Т = 298-3000 К
MgCO3
260,9
15,5
16,9
18,62
13,80
-4,16
CaO
-151,79
9,50
10,24
11,67
1,08
-1,56
CaCO3
-288,44
21,92
19,95
24,98
5,24
-6,20
Оксиды металлов, входящих в состав кернов
|
Zr |
0 |
9,29 |
6,01 |
6,65 |
1,11 |
-0,86 |
|
ZrO2 |
-263,04 |
12,12 |
13,40 |
16,64 |
1,,80 |
-3,36 |
-
Термодинамическая оценка окисляемости металлов при термообработке оксидного катода.
Общие сведения
Оксидные катоды являются в настоящее время одним из распространен-
ных типов термокатода, применяемых в электровакуумных приборах (ЭВП)
различных классов.
В процессе откачки ЭВП наибольшее газовыделение происходит на этапе
термообработки оксидного катода. Оксидное покрытие наносится на поверхность металлического керна катода в виде суспензии карбонатов щелочноземельных металлов Ва, Sr, Са. Основным соединением смеси, приготовленной на основе органического связывающего вещества (биндера), является ВаСО3. В процессе термообработки оксидного катода в вакууме сначала происходит разложение органической связки, сопровождающееся газовыделением и образованием углерода в покрытии. При увеличении температуры происходит разложение карбоната бария по реакции:
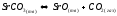 ;
(1.1)
;
(1.1)
имеющей константу равновесия kp1(T) = PСО2 .
Образующаяся,легированная металлическим стронцием и специальными присадками в керне; служит активным термоэмиссионным покрытием. Углекислый газ CО2, выделяющийся в реакции, способствует удалению углерода из оксидного слоя с помощью газотранспортной химической реакции:
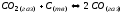 ; (1.2)
; (1.2)
закон действующих масс для
которой имеет вид :

Таким образом, при термообработке оксидного катода газовая фаза, в основном, содержит газы СО2 и СО. По отношению к металлам Ме, такая среда обладает окислительно-восстановительными свойствами:
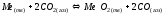 (1.3)
(1.3)
Закон действующих масс для
этой реакции имеет вид : 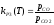
Направление протекания
реакции (1.3) обусловлено составом газовой
среды в вакуумном приборе. При этом
давления pСО2
и pСО,
формируемые реакциями (1.1) и (1.2), являются
для реакции (1.3) неравновесными, которые
определяются внешними условиями. В
общем случае они отличаются от равновесных
давлений, входящих в константу равновесия
kр3.
В дальнейшем равновесные давления будем
обозначать
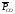 и
и
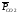 ,
т.е.
,
т.е.
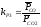 .
.
Таким образом, для оценки термодинамической возможности окисления металлических деталей арматуры прибора, следует в первую очередь провести расчет состава газовой среды, формируемой реакциями (1.1) и (1.2), а затем на основании уравнения изотермы Вант-Гоффа для реакции (1.3) определить направление ее протекания в газовой среде, созданной реакциями (1.1) и (1.2).
Расчет состава газовой фазы
Целью термодинамического расчета является нахождение температурных зависимостей рCO2(Тк) и рСО(Тк), где Тк - температура обработки катода. Обычно условия разложения карбонатов при термообработке таковы, что скорость газовыделения много больше скорости откачки. Таким образом, практическая ситуация соответствует изохорному процессу, протекающему в объеме, ограниченном вакуумной оболочкой прибора. В этом случае для реакций (I.I) и (1.2) надо применять закон действующих масс в форме:
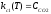 и
и
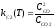
Отсюда для температуры Тк находим:
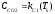 ;
; 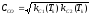 (1.4)
(1.4)
Связь kP(Т) и kC(Т) определяется из основного газового соотношения
pi = Ci RT:
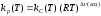 ;
(1.5)
;
(1.5)
где
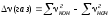 - изменение числа
молей газообразных компонентов
реакции. Тогда подставляя (1.5) в (1.4),
получаем:
- изменение числа
молей газообразных компонентов
реакции. Тогда подставляя (1.5) в (1.4),
получаем:
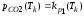 ;
;
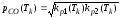 (1.6)
(1.6)
Таким образом, расчет состава газовой фазы сводится к нахождению температурной зависимости констант равновесия kР1(Т) и kР2(Т).
1.3. Расчет констант равновесия
Запишем химическую реакцию в обобщенном виде
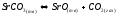 (1.7)
(1.7)
В основе расчета константы равновесия kp(Т) любой реакции лежит соотношение, выражающее kp через G0T:
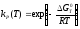 (1.8)
(1.8)
При этом стандартный изобарный потенциал G0T:
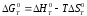 (1.9)
(1.9)
Таким образом, расчет kР(Т)
сводится к вычислению НТ0
и
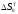 для конкретной химической реакции.
Исходными для расчета служат выражения:
для конкретной химической реакции.
Исходными для расчета служат выражения:
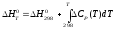 ;
(1.10)
;
(1.10)
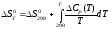 ;
(1.11)
;
(1.11)
где
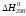 и
и
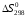 – стандартные тепловой эффект и изменение
энтропии реакции при Т
= 298 К, Ср(Т)
- изменение изобарной теплоемкости в
реакции, зависящее от температуры.
– стандартные тепловой эффект и изменение
энтропии реакции при Т
= 298 К, Ср(Т)
- изменение изобарной теплоемкости в
реакции, зависящее от температуры.
Для определения
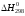 и
и
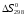 используют выражения:
используют выражения:
 ; (1.12)
; (1.12)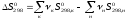 ;
(1.13)
;
(1.13)
где
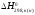 и
и

 –
стандартные теплоты образования
соединений из простых веществ и
стандартные энтропии веществ.
–
стандартные теплоты образования
соединений из простых веществ и
стандартные энтропии веществ.
Для вычисления СP(T) применяют выражение, аналогичное по форме выражениям (1.12) и (1.13):
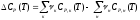 (1.14)
(1.14)
Температурная зависимость изобарных теплоемкостей СP,к(н)(T) аппроксимируется функцией:
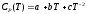 ;
(1.15)
;
(1.15)
где a ,b и c - коэффициенты, заданные для данного вещества.
Таким образом, расчет
температурной зависимости kр(Т)
через
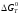 ,
в соответствии с (1.8), проводят по формулам
(1.9)
(1.15).
,
в соответствии с (1.8), проводят по формулам
(1.9)
(1.15).
-
Расчет констант равновесия для SrCO3↔SrO+CO2 и CO2+C↔2CO
Найдем изменение энтальпии и энтропии
для каждой из реакций, после этого по
формуле (1.8) определим их константы
равновесия и построим графики зависимостей
давления от температуры Pco(T)
и Pco2(T)
и
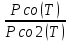 .
.
Для реакции SrCO3↔SrO+CO2 сделаем это в трех приближениях
