
- •Неорганическая химия. Химия элементов
- •Глава 18
- •18.1. Общая характеристика
- •18.1.1. Положение в Периодической системе
- •18.1.2. Строение электронной оболочки, валентность, основные типы химических соединений
- •18.1.3. Нахождение в природе, изотопный состав
- •18.1.4. Краткие исторические сведения
- •18.2. Простые вещества
- •18.3. Сложные соединения элементов 18-й группы
- •18.3.1. Клатраты благородных газов
- •18.3.2. Кислородные соединения и соли кислородсодержащих кислот
- •18.3.3. Галогениды и оксогалогениды
- •18 3.3.1. Фториды ксенона
- •IV(кубическая) III(моноклинная) II(ромбическая) I(моноклинная)
- •18.3.3.2. Фториды других элементов 18-й группы
- •18.3.3.3. Оксофториды
- •18.4. Комплексные соединения элементов 18-й группы
- •18.5. Короткоживущие соединения благородных газов
- •18.6. Биологическая роль благородных газов
18.2. Простые вещества
Простые вещества элементов 18-й группы при нормальных условиях являются одноатомными газами без цвета и запаха. Одноатомность молекул благородных газов отличает их от молекул других известных газообразных простых веществ - галогенов, кислорода, азота, водорода. Это объясняется тем, что на связывающих и разрыхляющих орбиталях гипотетических двухатомных молекул благородных газов (Э2) находилось бы одинаковое число электронов, и, следовательно, порядок связи был бы равен нулю (рис. 18.1, см. также МО молекулы Н2, разд. 1.2.1).
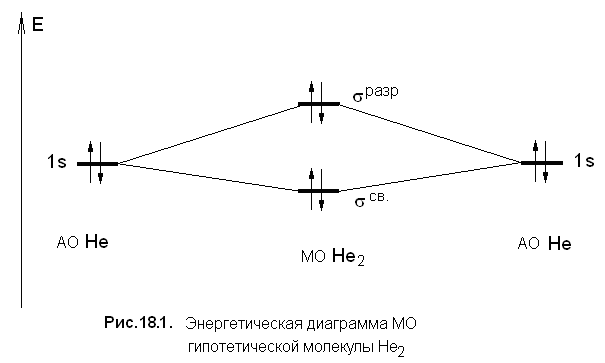
Диаграмма МО делает понятным, почему возможно существование молекулярных ионов НеН+ и Не2+ (см. разд. 18.5), кратность связи в которых равна 1 и 0,5 соответственно.
Физические свойства благородных газов (табл.18.4) закономерно изменяются с ростом их атомного номера и атомного радиуса. Более высокие ТПЛ и ТКИП имеют тяжелые инертные газы.
Элемент |
ТПЛ, 0C |
ТКИП, 0C |
Критическая температура, 0С |
Критическое давление, атм |
Плотность, г/дм3 |
|
при 00С и 1 атм |
при ТКИП |
|||||
Не |
-272,2 (26 атм) |
-268,9 |
-268 |
2,26 |
0,178 |
0,126 |
Ne |
-248,6 |
-245,9 |
-229 |
26,19 |
0,900 |
1,20 |
Ar |
-189,4 |
-185,8 |
-122 |
48,3 |
1,784 |
1,40 |
Kr |
-157,3 |
-153,3 |
-63 |
54,3 |
3,749 |
2,60 |
Xe |
-111,9 |
-108,1 |
-17 |
57,64 |
5,897 |
3,06 |
Rn |
-71,0 |
-61,9 |
104 |
65 |
9,73 |
4,40 |
Элемент |
Растворимость при 200С и 1 атм, см3/кг Н2О |
Коэффициент поляризуемости, 1024, мл |
Свечение в разряде |
Не |
8,61 |
0,23 |
Желтое |
Ne |
10,5 |
0,38 |
Оранжевое |
Ar |
33,6 |
1,57 |
Красное |
Kr |
59,4 |
2,70 |
Зелено-фиолетовое |
Xe |
108,1 |
4,05 |
Фиолетовое |
Rn |
230 |
5,42 |
Белое |
При переходе от легких к тяжелым аналогам увеличивается растворимость благородных газов в воде. Эти закономерности в изменении свойств определяются увеличением деформируемости электронной оболочки элементов по мере роста их радиуса и числа электронных слоев. Указанные в табл. 18.4 значения коэффициентов поляризуемости изменяются симбатно с другими величинами, приведенными там же. Это позволяет говорить об уменьшении «инертности» благородных газов по мере увеличения их атомного номера: несмотря на завершенность внешнего электронного слоя (октета), для тяжелых элементов этой группы характерно возрастание межатомного взаимодействия (рост ТПЛ и ТКИП), а также некоторое увеличение растворимости в воде, которое свидетельствует о росте взаимодействия с водой.
Особое место среди благородных газов занимает самый легкий из них - гелий, его температура плавления (даже при высоком давлении) весьма близка к абсолютному нулю. Это связано с предельной жесткостью (максимальным «благородством») электронной оболочки гелия 1s2. Практически полное отсутствие взаимодействия между атомами Не объясняет и тот факт, что при обычной температуре расширяющийся гелий не охлаждается, а нагревается. Только ниже -2500С для гелия наблюдается нормальный эффект Джоуля - Томсона (охлаждение газа при его расширении). В связи с этим гелий сжижают и переводят в твердое состояние, применяя охлаждение жидким водородом (ТКИП = -252,60С). Твердый гелий устойчив только при давлении выше 25 атм.
У жидкого гелия имеются два состояния: Не I, который проявляет свойства обычной жидкости (устойчив выше 2,19 К), и Не II, существующий ниже 2,19 К. Жидкий Не II - единственная из жидкостей, которая не затвердевает под давлением своих паров при температуре, близкой к 0 К. Теплопроводность Не II но много десятков раз выше, чем у меди. Поэтому на стенках сосуда не образуются характерные для кипящей жидкости пузырьки газа. Испаряется Не II только с поверхности.
Не II практически не имеет вязкости (она в 105 раз меньше вязкости газообразного водорода). Поэтому он легко и быстро течет через щели и капилляры, вытекает по стенкам сосуда, не испытывая трения («сверхтекучесть»). Именно сверхтекучесть является причиной образования пленок Не II толщиной до 2 микрон, распространяющихся на поверхности твердых тел с большой скоростью до (20 см/с) и способствующих вытеканию гелия из сосудов-хранилищ. Это явление было открыто советским физиком П.Л. Капицей в 1938 г., а теория сверхтекучести создана в 1941- 1944 гг. советским ученым Л.Д. Ландау, который рассматривал сверхтекучий гелий как единственную из известных «квантовую» жидкость, с присущим ей одной набором энергетических уровней. Аномальная текучесть возникает из-зa двойственного энергетического состояния aтомов гелия: Не II состоит как бы из двух жидкостей (α и β), которые принципиально неразделимы, но движутся независимо друг от друга без взаимодействия (трения). При этом α-жидкость содержит в себе «все тепло» Не II и движется обычным образом. В β-жидкости отсутствует тепловое движение, она как бы находится строго при 0 К.
Изучено кристаллическое состояние всех благородных газов, кроме радона. Их структура обычно - кубическая плотнейшая упаковка. Связи между атомами осуществляются дисперсионными силами. Существуют также кристаллические модификации Не, Ne, Кr и Хе со структурой типа гексагональной плотнейшей упаковки.
Интересно, что изотопный состав гелия сильно влияет па структурные параметры, которые для 3Не и 4Не отличаются приблизительно на 0,15 Å. Это один из немногих случаев, когда различия в физических свойствах изотопов сильно сказываются на характеристиках элемента. Сильнее всего изотопный состав влияет на физические и химические свойства соединений у предшественника гелия по ПС - самого легкого элемента водорода (см. разд. 1.1.3).
Несмотря на стабильность электронных оболочек, атомную структуру благородных газов можно преобразовать в металлоподобную, где взаимодействие между атомами будет существенным. Принцип, используемый при такой перестройке, аналогичен упомянутому при обсуждении металлоподобных водорода, азота и иода. Среди благородных газов проще всего получить металлоподобный ксенон - его электронная структура легче, чем у других элементов 18-й группы (за исключением Rn), подвергается модифицированию. Превращение твердого Хе с атомной (молекулярного типа) структурой, обладающего свойствами изолятора, в металлоподобное вещество со свойствами электрического проводника по оценке происходит при 500 000 атм.
Для проверки теоретических расчетов в камеру сверхвысокого давления, изготовленную из поликристаллическою алмаза, охлажденную до температуры ниже -111,90С (ТПЛ Хе), по подогреваемому капилляру вводили Хе. Твердый Хе обычной структуры заполнял камеру. В камере создавали сверхвысокое давление и продолжали охлаждение системы. Электрическое сопротивление резко понижалось, так как Хе переходил в металлическое состояние. При температуре, близкой к ТПЛ жидкого Не (-2690С), Хе начинал проявлять свойства сверхпроводника. Этот эксперимент доказал, таким образом, что Хе может иметь структуру, характерную для металлов, т.е. структуру с весьма сильным межатомным взаимодействием. Однако металлоподобный ксенон устойчив только при низкой температуре и очень высоком давлении.
Ионизация атомов благородных газов происходит, когда на электроды разрядных трубок, содержащих благородные газы, подают высокое напряжение. При этом наблюдается свечение благородных газов (см. табл. 18.4).
Химические свойства благородных газов стали систематически изучаться лишь после обнаружения их «истинных» соединений (см. разд. 18.1.2).
Непосредственно с тяжелыми инертными газами (Кr, Хе, Rn) реагирует лишь фтор, образуя при этом фториды, состав которых зависит от условий эксперимента. Благородные газы взаимодействуют с водой, давая гидраты постоянного состава, имеющие клатратное строение. В высокотемпературной плазме получены соединения всех благородных газов с рядом элементов (фтором, водородом и др.), правда, в чрезвычайно малых количествах, так что идентифицировать их удалось только методами масс-спектрометрии и оптической спектроскопии.
Промышленными источниками благородных газов являются воздух, горные породы и природные газы. Гелий получают главным образом из газовой смеси, поступающей из недр Земли. При пропускании газов через поглотители из активированного угля, охлаждаемые жидким воздухом, гелий, в отличие от других составляющих газовой смеси, не сорбируется, а неон, если он в этой смеси присутствует, сорбируется плохо. Дальнейшую очистку гелия от других благородных газов проводят при охлаждении твердым водородом.
Остальные благородные газы, кроме Rn, выделяют методом фракционной дистилляции жидкого воздуха. Источником радона служат препараты урана, радия и других радиоактивных элементов. Для его получения через водные растворы солей радия продувают воздух, который захватывает присутствующий в растворе радон. Отделяют радон от воздуха охлаждением смеси газов твердым СО2 или пропусканием через поглотитель из активированного угля: в первом случае радон конденсируется, во втором - адсорбируется.
Благородные газы используют для создания инертной атмосферы в ходе химического промышленного и лабораторного синтеза, если необходимо исключить процессы окисления (например, при литье металлов). С той же целью благородными газами (Кr и Хе) заполняют баллоны ламп накаливания - срок работы таких ламп удлиняется. Гелий применяют как охлаждающую жидкость в ЯМР-исследованиях, при электродуговой сварке, для заполнения метеорологических зондов, как газ для кессонов (гелий меньше растворим в плазме крови, чем азот). Благородными газами заполняют рекламные разрядные трубки. Благородные газы используют при консервировании продуктов. В лечебных целях применяют воды, содержащие радон (так называемые радоновые ванны).
