
- •Іі Розвиток уявлень про атом
- •1. Ідея атомізма. Дискретність речовини. Дискретність електричного заряду
- •2. Спектри випромінювання тіл. Лінійчасті спектри атомів. Серіальна формула Бальмера
- •1) Тверді тіла і рідини випромінюють суцільний спектр.
- •2) Спектри молекул – полосаті (окремі полоси).
- •3) Спектри атомів в газоподібному стані мають чітко окреслені лінії – їх називають лінійчастими.
- •3. Модель атома Томсона
- •4. Дослід Резерфорда. Ядерна модель атома
- •5. Протиріччя ядерної моделі атома Резерфорда з законами класичної фізики.
- •6. Постулати Бора. Правило квантування Бора.
- •1. Електрони в атомі рухаються тільки по дозволеним стаціонарним орбітам, не випромінюючи і не поглинаючи енергію.
- •7. Напівквантова модель атома Бора
- •8. Дослід Франка і Герца
3. Модель атома Томсона
У
1903 р. Томсон запропонував модель атома,
згідно якій він уявлявся у вигляді
сфери, яка рівномірно заповнена позитивним
зарядом і всередині якої містяться
електрони; електрони утримуються біля
положень рівноваги квазіпружною силою
 ,
де r
- відхилення електрона від положення
рівноваги. В цілому атом не має електричного
заряду. Напруженість поля в середині
рівномірно зарядженої кулі:
,
де r
- відхилення електрона від положення
рівноваги. В цілому атом не має електричного
заряду. Напруженість поля в середині
рівномірно зарядженої кулі:


 ,
,
де е – заряд кулі, R – його радіус. На електрон діє сила:

і він може коливатися з циклічною частотою

З цього співвідношення можна оцінити розмір атому

При
 (оптичний діапазон)
(оптичний діапазон)



4. Дослід Резерфорда. Ядерна модель атома
У 1911р. англійський фізик Резерфорд висунув ідею про ядерну будову атома, згідно якої позитивний заряд розміщений в центрі атома, а навколо нього знаходяться електрони.
Питання про те, яка модель відповідає дійсності, могло бути розв’язане тільки експериментально. Відповідь на нього дали досліди Резерфорда по розсіянню -частинок речовиною, які були виконані в 1913 році. Схема досліду зображена на рисунку.. Тут Р – радіоактивний препарат, який випромінює -частинки, що мають електричний заряд +2е; Ф - тонка металева фольга (золото, платина та інші); Э- екран із ZnS (сірчаного цинку), який рухався по колу разом з мікроскопом М навколо точки падіння пучка -частинок на фольгу. При попаданні -частинок на екран виникали сциптиляції. Спостереження в мікроскоп зводилося до визначення кількості сциптиляцій за певний проміжок часу при положенні екрану під різними кутами .
Досліди
показали, що при проходженні через
фольгу більшість -
частинок зазнає дуже незначних відхилень,
але є чимала кількість й таких частинок,
які зазнають дуже великих відхилень.
Одна частинка з
 8000
зазнавала відхилення на кут більший за
150о
, тобто заверталася назад. Електрони,
маса яких у
8000
зазнавала відхилення на кут більший за
150о
, тобто заверталася назад. Електрони,
маса яких у
 7000
разів менша за масу -частинок
не могли вплинути на їх рух. Великі
відхилення -частинок
свідчили про те, що розміри позитивного
заряду в атомі значно менші ніж розмір
атома.
7000
разів менша за масу -частинок
не могли вплинути на їх рух. Великі
відхилення -частинок
свідчили про те, що розміри позитивного
заряду в атомі значно менші ніж розмір
атома.
Якщо вважати що -частинка рухається прямо на позитивний заряд ядра атома, то можна оцінити мінімальну відстань між центрами ядра та -частинки при її повній зупинці, прирівнявши кінетичну енергію останньої і потенціальну енергію взаємодії їх зарядів:
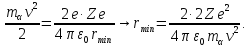
Тоді
при
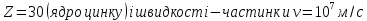
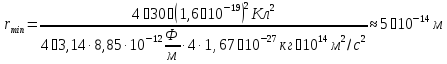
Тобто розміри ядра виявилися менші розмірів атома в ~ 10000 - 100000 разів. Майже вся маса атому зосереджена в його ядрі.
Таким чином, модель атома Томсона була відкинута й замінена ядерною (або планетарною) моделлю Резерфорда.
5. Протиріччя ядерної моделі атома Резерфорда з законами класичної фізики.
Модель атома Резерфорда пояснювала розсіяння -частинок при проходженні металевої фольги, проте з погляду законів класичної фізики вона була неспроможна пояснити:
1. Стійкість атома (його довгоживучість);
2. Закономірностей в лінійчастих спектрах атомів;
3. Факт випромінювання атомом монохроматичного світла;

Суть у тому, що за законами класичної електродинаміки обертання електрона навколо ядра, завдяки доцентровому прискоренню, має супроводжуватися випромінюванням електромагнітних хвиль. В результаті випромінювання, енергія електрона має поступово зменшуватися, як і відстань електрона до ядра. Випромінювання електрона давало б суцільний спектр, а електрон швидко (за 10-10 с) впав би на ядро. Ці наслідки класичної теорії не відповідали дійсності.
