
- •Іі Розвиток уявлень про атом
- •1. Ідея атомізма. Дискретність речовини. Дискретність електричного заряду
- •2. Спектри випромінювання тіл. Лінійчасті спектри атомів. Серіальна формула Бальмера
- •1) Тверді тіла і рідини випромінюють суцільний спектр.
- •2) Спектри молекул – полосаті (окремі полоси).
- •3) Спектри атомів в газоподібному стані мають чітко окреслені лінії – їх називають лінійчастими.
- •3. Модель атома Томсона
- •4. Дослід Резерфорда. Ядерна модель атома
- •5. Протиріччя ядерної моделі атома Резерфорда з законами класичної фізики.
- •6. Постулати Бора. Правило квантування Бора.
- •1. Електрони в атомі рухаються тільки по дозволеним стаціонарним орбітам, не випромінюючи і не поглинаючи енергію.
- •7. Напівквантова модель атома Бора
- •8. Дослід Франка і Герца
Іі Розвиток уявлень про атом
1. Ідея атомізма. Дискретність речовини. Дискретність електричного заряду.
2. Спектри випромінювання тіл. Лінійчасті спектри атомів. Серіальна формула Бальмера
3. Модель атома Томсона.
4. Досліди Резерфорда. Ядерна модель атома .
5. Протирічча ядерної моделі атома Резерфорда з законами класичної фізики.
6. Постулати Бора. Правило квантування Бора.
7. Напівквантова модель атома Бора
8. Дослід Франка і Герца.
1. Ідея атомізма. Дискретність речовини. Дискретність електричного заряду
Словом “атом” давньогрецькі філософи Левкіп (500-440 рр. до н.е.) та Демокріт (460-370 рр. до н.е.) називали найменші неподільні частинки любого тіла. На їхню думку – кожній речовині відповідали свої атоми. Таке поняття атома проіснувало більше 2000 років. Не всі вчені до кінця 19 століття вірили в існування атома. (фізик Мах, хімик Оствальд до вручення Нобелівської премії по хімії у 1911 р.). Відкриття “атома” стало визначним досягненням фізики, яке привело до побудови нової фізичної теорії - квантової механіки, яка принципово відрізняється від класичної механіки Ньютона. “Наука рухається вперед спираючись на дві ноги – теорію та експеримент.” Це цитата з лекції американського фізика Міллікена при врученні йому Нобелівської премії в 1924 році. В даному розділі ми познайомимося з основними експериментальними фактами та фізичними теоріями, які заклали основу сучасної фізики.
У
1897 р. англійський фізик Джозеф Джон
Томсон досліджуючи відхилення катодних
променів в магнітних та електричних
полях встановив, що вони представляють
собою потік частинок, які несуть на собі
від’ємний електричний заряд. Він
визначив питомий електричний заряд
 частинок. Це була перша елементарна
частинка - електрон, назву якій дав
Стоней ще у 1891 р., яка входила до складу
речовини. Наступні досліди Роберта
Міллікена (1906-1913рр.), з великою точністю
вимірявшого заряд електрона, остаточно
довели існування частинки і дискретність
електричного заряду. Таким чином,
наприкінці ХІХ століття стало ясно, що
атом це не “неподільна” частинка, а
складна електрична система.
частинок. Це була перша елементарна
частинка - електрон, назву якій дав
Стоней ще у 1891 р., яка входила до складу
речовини. Наступні досліди Роберта
Міллікена (1906-1913рр.), з великою точністю
вимірявшого заряд електрона, остаточно
довели існування частинки і дискретність
електричного заряду. Таким чином,
наприкінці ХІХ століття стало ясно, що
атом це не “неподільна” частинка, а
складна електрична система.
2. Спектри випромінювання тіл. Лінійчасті спектри атомів. Серіальна формула Бальмера
В другій половині 19-го століття почалося широке вивчення спектрів різних тіл. Було встановлено, що:
1) Тверді тіла і рідини випромінюють суцільний спектр.
2) Спектри молекул – полосаті (окремі полоси).
3) Спектри атомів в газоподібному стані мають чітко окреслені лінії – їх називають лінійчастими.
Кожний елемент в атомарному стані має свій лінійчастий спектр. Цей спектр не залежить від способу збудження. Виявилося, що розташування ліній в спектрах того чи іншого елемента має свої закономірності.
Швейцарський фізик Бальмер у 1885р. відкрив серію ліній в оптичній частині спектра водню, яку можна представити слідуючою простою формулою:
Серія
Бальмера:

Де
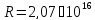 рад/с –
постійна Рідберга, ω
– циклічна частота випромінювання.
рад/с –
постійна Рідберга, ω
– циклічна частота випромінювання.
Лайман відкрив у 1906 р. другу серію ліній, розташовану в ультрафіолетовій частині спектра атому водню.
Серія
Лаймана:

Пашен відкрив у 1908 р. третю серію ліній, розташовану в інфрачервоній частині спектра атома водню.
Серія
Пашена:
Пізніше в інфрачервоній області знайдені
Серія
Брекета: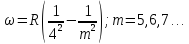
Серія
Пфунда:

 ,
,
та інші.
Таким чином, частоти всіх ліній спектра атома водню можна описати однією формулою:
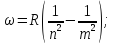 -
Серіальна
формула Бальмера (1)
-
Серіальна
формула Бальмера (1)
де
 , причому
, причому
 для кожної
серії.
для кожної
серії.
