
- •Термодинаміка
- •7.1 Внутрішня енергія системи. Кількість теплоти. Перше начало термодинаміки
- •7.2 Степені вільності молекул. Розподіл енергії по степеням вільності. Внутрішня енергія ідеального газу
- •Робота газу в ізопроцесах
- •7.4 Молекулярно-кінетична теорія теплоємності газів
- •3.5 Адіабатний процес
- •4.1 Оборотні і необоротні процеси. Термодинамічні цикли
- •4.2 Принцип дії теплової машин та її коефіцієнт корисної дії (ккд). Друге начало термодинаміки
- •4.3 Ідеальна теплова машина Карно та її ккд
- •4.4 Принцип дії холодильної машини. Холодильний коефіцієнт
- •4.5 Зведена кількість теплоти. Поняття про ентропію.
- •4.6 Властивості ентропії та її фізичний зміст. Теорема Нернста. Вільна енергія системи
- •4.7 Зміна ентропії ідеального газу
-
Робота газу в ізопроцесах
Нехай
газ, який знаходиться в циліндрі під
поршнем площею S,
розширюючись переміщує його на відстань
dx
. Тиск газу
Р. За означенням елементарна механічна
робота дорівнює
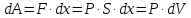 ,
(7.6)
,
(7.6)
а
загальна робота буде:
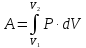 .
(7.7)
.
(7.7)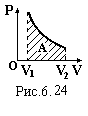
Графічно в координатах Р-V робота газу дорівнює площі криволінійної трапеції, обмеженої графіком процесу, віссю об’єму V і лініями V1 = const, V2 = const.
Знайдемо роботу газу в різних ізопроцесах:
-
Ізохорний. Так як V = const, dV = 0, тому dAV = 0 і
АV = 0. (7.8)
2) Ізобарний. Р = const. Взявши до уваги рівняння Клапейрона-Менделєєва, одержуємо
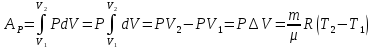 .
(7.9)
.
(7.9)
3) Ізотермічний. Т = const.
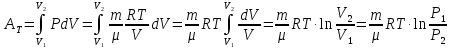 .
(7.10)
.
(7.10)
7.4 Молекулярно-кінетична теорія теплоємності газів
Питомою теплоємністю називається кількість теплоти, яка необхідна для нагрівання 1 кг речовини на 1К (або на 1 градус цельсія)
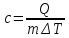 [ Дж/(кг·К)]
(7.11)
[ Дж/(кг·К)]
(7.11)
Молярною теплоємністю називається кількість теплоти, яка необхідна для нагрівання 1 моля речовини на 1К (або на 1 градус цельсія)
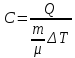 [
Дж/(моль·К)]
(7.12)
[
Дж/(моль·К)]
(7.12)
Ці теплоємності зв’язані між собою співвідношенням
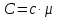 .
.
Розглянемо два режими нагрівання газу: ізохорний і ізобарний.
1.Ізохорний.
При
ізохорному
процесі АV
= 0. Тоді, враховуючи перше начало
термодинаміки (7.1) і вираз для внутрішньої
енергії ідеального газу (7.5), кількість
теплоти, необхідна для нагрівання
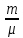 молей газу на ∆Т буде
молей газу на ∆Т буде 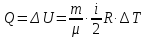 .
.
Підставляємо в (7.12). Одержуємо
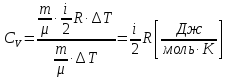 .
(7.13)
.
(7.13)
-
Ізобарний.
Враховуючи
(7.1) і (7.9) кількість теплоти, необхідна
для нагрівання
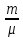 молей газу на ∆Т
молей газу на ∆Т
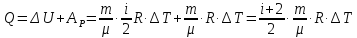 .
.
Підставляємо в (7.12). Одержуємо
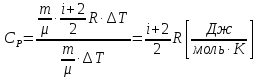 .
(7.14)
.
(7.14)
Рівняння (7.14) можна записати так:
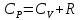 .
(7.15)
.
(7.15)
Його називають співвідношенням Майєра.
Теплоємність Ср > CV тому, що при ізобарному процесі підведене тепло іде не тільки на зміну внутрішньої енергії (як при ізохорному процесі), а і на виконання роботи. Ясно, що в цьому випадку потрібно підвести більшу кількість теплоти.
Характерним для кожного газу є відношення теплоємностей
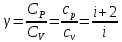 .
(7.16)
.
(7.16)
Одержані
вирази для теплоємностей газу показують,
що вони не залежать від температури.
Але експеримент дає ступінчату залежність
для газів багатоатомних молекул. Таку
залежність неможливо пояснити в рамках
класичної фізики. Вона пояснюється в
рамках квантових уявлень, а саме
дискретним характером зміни фізичних
величин, в нашому випадку обертальної
та коливальної енергії молекул. При
низьких температурах теплової
енергії не вистачає для збудження
обертального руху молекул і коливального
руху атомів в них. Тобто, обертальні і
коливальні степені вільності не
збуджуються. Вони послідовно починають
збуджуватись при підвищенні температури.
Наприклад, двохатомні молекули при
зіткненні, як показано на рисунку, не
приходять в обертальний рух. В той час
як по класичним уявлення при такому
зіткненні молекули повинні прийти в
обертання. Отже, залежність СР
(Т) зумовлена
ступінчатою зміною кількості степенів
вільності (числа і).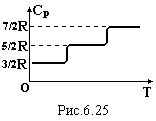
![]()
