
- •Термодинаміка
- •7.1 Внутрішня енергія системи. Кількість теплоти. Перше начало термодинаміки
- •7.2 Степені вільності молекул. Розподіл енергії по степеням вільності. Внутрішня енергія ідеального газу
- •Робота газу в ізопроцесах
- •7.4 Молекулярно-кінетична теорія теплоємності газів
- •3.5 Адіабатний процес
- •4.1 Оборотні і необоротні процеси. Термодинамічні цикли
- •4.2 Принцип дії теплової машин та її коефіцієнт корисної дії (ккд). Друге начало термодинаміки
- •4.3 Ідеальна теплова машина Карно та її ккд
- •4.4 Принцип дії холодильної машини. Холодильний коефіцієнт
- •4.5 Зведена кількість теплоти. Поняття про ентропію.
- •4.6 Властивості ентропії та її фізичний зміст. Теорема Нернста. Вільна енергія системи
- •4.7 Зміна ентропії ідеального газу
Л-07.
Термодинаміка
7.1 Внутрішня енергія системи. Кількість теплоти. Перше начало термодинаміки
Внутрішня енергія тіла – це сума кінетичної енергії всіх молекул тіла і потенціальної енергії їх взаємодії. Внутрішню енергію можна змінити трьома процесами:
-
За рахунок виконання системою чи над нею роботи. Наприклад, при стискуванні газу в циліндрі від рухомого поршня молекули будуть відбиватись з більшою на подвоєну швидкість поршня швидкістю, ніж падають. А це означає збільшення кінетичної енергії хаотичного руху молекул, тобто внутрішньої енергії газу, при виконанні над ним роботи по його стисканню. Аналогічно при розширенні газу, тобто при виконанні ним роботи, молекули будуть відбиватись від поршні з меншою швидкістю, ніж падати. Отже, якщо система виконує роботу, її внутрішня енергія зменшується. Якщо над системою виконується робота, її внутрішня енергія зростає.
-
За рахунок теплообміну. Теплообмін – передача тілу або забирання від тіла енергії без виконання механічної роботи. Цю енергію називають кількістю теплоти або просто теплотою. Якщо теплота передається системі, її внутрішня енергія зростає, якщо ж забирається – зменшується.
-
За рахунок зміни кількості частинок системи. Цей процес поки що розглядати не будемо, тобто будемо вивчати системи незмінної кількості частинок.
Таким чином механічна робота і теплота являються мірою зміни внутрішньої енергії. Тому ці три фізичні величини мають однакову розмірність – джоуль (Дж). Одиницею теплоти являється позасистемна одиниця – калорія. Це кількість теплоти, необхідна для нагрівання 1 г води від 19,5оС до 20,5оС. Еквівалентність теплоти і роботи експериментально встановив Джоуль по нагріванню ртуті при її перемішуванні лопатками, які приводились в рух падаючою гирею. Він встановив, що 1 кал = 4,19 Дж.
Таким
чином з врахуванням знаків роботи,
кількості теплоти і зміни внутрішньої
енергії, можна сформулювати закон
збереження енергії (перше начало
термодинаміки): 
 (7.1)
(7.1)
Кількість теплоти Q, переданої термодинамічній системі, іде на зміну її внутрішньої енергії ∆U і на виконання системою роботи A над зовнішніми тілами.
Або в диференціальному вигляді:
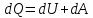 (7.2)
(7.2)
7.2 Степені вільності молекул. Розподіл енергії по степеням вільності. Внутрішня енергія ідеального газу
Числом степенів вільності називається мінімальна кількість незалежних величин, якими можна однозначно описати положення молекули (даної системи) у просторі.
Для
матеріальної точки (молекула одноатомного
газу) у просторі достатньо вказати три
координати x,
y,
z.
Ці координатні степені вільності
називаються поступальними. Для двохатомної
жорсткої молекули задають три координати
одного із атомів і два кути: полярний θ
і азимутальний φ. Ці кутові степені
вільності називаються обертальними.
Всього одержали
 .
.

Для двохатомної нежорсткої молекули, тобто коли відстань між атомами може змінюватись, що має місце при досить високих температурах, тобто атоми коливаються, потрібно задати ще одну степінь вільності – відстань між атомами. Ця степінь вільності називається коливальною. Одержуємо
 .
.
Для
трьохатомної жорсткої молекули необхідно
задати як і для двохатомної жорсткої
молекули три координати одного і три
кути. Третій кут γ задає орієнтацію
площини молекули. Одержуємо
 .
.
У
випадку нежорсткої трьохатомної молекули
необхідно додати ще 3 відстані між
атомами – 3 коливальні степені вільності.
Всього буде 9. Із збільшенням кількості
атомів буде зростати кількість коливальних
степенів вільності, а поступальних і
обертальних буде по 3. Таким чином,
система із N
частинок має
 степенів вільності.
степенів вільності.
Теплова
енергія по степеням вільності
розподіляється рівномірно,
тобто на кожну поступальну і обертальну
степені припадає енергія
 , а на коливальну kT
(
, а на коливальну kT
( на
кінетичну енергію коливань атомів в
молекулі,
на
кінетичну енергію коливань атомів в
молекулі,
 на потенціальну їх взаємодію). Кількість
половинок kT
енергії позначимо буквою і.
Тоді
на потенціальну їх взаємодію). Кількість
половинок kT
енергії позначимо буквою і.
Тоді
 .
(7.3)
.
(7.3)
Досить часто мають справу з невисокими температурами, коли коливальні степені ще не збуджуються. Тоді число і дорівнює числу n кількості степенів вільності. Тому досить часто число і називають кількістю степенів вільності.
Середня теплова енергія молекули, яку розглядають не як матеріальну точку, включає не тільки поступальну енергію, а і обертальну та коливальну. Тому
 .
(7.4)
.
(7.4)
Внутрішня енергія ідеального газу складається із кінетичної енергії молекул (бо у відповідності до означення ідеального газу його потенціальною енергією взаємодії між молекулами нехтують).
Отже,
 ,
(7.5)
,
(7.5)
де: NA – число Авогадро, m – маса газу, μ – молярна маса, k – стала Больцмана, R – газова стала, Т – абсолютна температура.
Вираз (7.5) показує, що внутрішня енергія даної кількості газу залежить тільки від температури.
