
2 курс / Л-6.1 (1) Молекулярна фізика
.docx
Молекулярна фізика
Молекулярна фізика – це розділ фізики, який вивчає фізичні властивості і стани речовин в залежності від їх молекулярної будови і сил взаємодії між молекулами.
Системи великої кількості частинок вивчає також розділ фізики – термодинаміка. Це вчення про зв’язок і взаємні перетворення енергії, теплоти і роботи. Термодинаміка наука феноменологічна (описова). Вона не дає пояснення тих чи інших явищ, властивостей на молекулярному рівні, а встановлює зв’язок між параметрами системи, наприклад, тиском, об’ємом, температурою, кількістю теплоти, роботою, ентропією, вільною енергією і т.д.
Обидва розділи доповнюють один одного.
6 Молекулярна фізика
6.1 Основні положення молекулярно-кінетичної теорії
Молекулярна фізика базується на трьох основних положеннях:
-
всі тіла складаються із молекул і атомів;
-
молекули і атоми хаотично рухаються;
-
між молекулами і атомами існують сили взаємодії.
Молекулярно-кінетична теорія пояснює властивості тіл виходячи с характеру руху молекул і сил взаємодії між ними. Враховуючи, що кількість молекул дуже велика (в 1см3 газу при нормальних умовах міститься 2,69∙1019молекул), вивчення систем такої великої кількості частинок не можна звести до вивчення руху кожної молекули. В таких системах проявляються специфічні статистичні закономірності. Наприклад, швидкості молекул можуть бути самими різними і знати всі їх значення неможливо, та і безкорисно тим більше, що вони весь час змінюються при зіткненнях. А ось середнє значення швидкості залишається сталим і характеризує стан системи.
Наприклад, тиск газу зумовлений ударами молекул об стінки посудини зазнає флуктуацій з часом (див. рис.), але його середнє значення не змінюється і його можна виміряти експериментально. Таким чином, задача молекулярно-кінетичної теорії – це знаходження середніх значень фізичних величин, які характеризують системи великої кількості частинок і які можна виміряти експериментально. Для цього використовується статистичні методи, в основі яких лежить теорія ймовірності.
-
Рівняння стану ідеального газу (Клапейрона-Менделєєва)
Ідеальний – це газ, в якому нехтують власним об’ємом молекул і силами взаємодії між ними.
Стан газу характеризується такими величинами: m – маса, P – тиск, V – об’єм, T – абсолютна температура. Зв’язок між усіма чотирма параметрами дає рівняння стану ідеального газу – рівняння Клапейрона-Менделєєва:
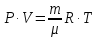 .
(6.1)
.
(6.1)
Тут μ – молярна маса газу, R = 8,31 Дж/(моль∙К) – універсальна газова стала.
-
Основне рівняння молекулярно-кінетичної теорії
Основним рівнянням молекулярно-кінетичної теорії називається рівняння, яке дає зв’язок між тиском газу і енергією поступального руху молекул. Знайдемо це рівняння в таких припущеннях:
-
всі молекули рухаються з однаковими швидкостями;
-
так як рух молекул хаотичний, то всі напрямки руху рівно ймовірні, тобто можна вважати, що вздовж будь-якого напрямку рухається однакова кількість молекул. Тому припустимо, що молекули рухаються тільки вздовж координатних осей х, y, z. Тоді можна вважати, що вздовж кожної осі рухається 1/3 частина всіх молекул.
Тиск газу пояснюється зміною імпульсу молекул при зіткненні і відбиванні їх із стінкою посудини. У відповідності з другим законом Ньютона на молекулу з боку стінки діє сила, а згідно з третім законом Ньютона, на стінку з боку молекули буде діяти така ж за величиною сила. Відношення сили до площі і є тиск.
Виберемо
на поверхні посудини малу плоску площадку
∆S.
Вісь ох направимо перпендикулярно до
цієї площадки, осі оy
і oz
паралельні їй. Знайдемо кількість
молекул ∆N,
які за час ∆t
зіткнуться з цією площадкою. Це будуть
молекули, які рухаються до площадки, а
це половина тих молекул, які рухаються
вздовж осі ох, і віддалені від неї на
відстань, не більшу ніж V∙∆t.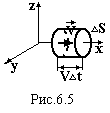
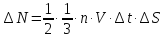
. При пружному ударі імпульс молекули змінюється на 2mV. Якщо удар не пружний, тобто молекула прилипає до поверхні, то імпульс зміниться на mV. Але після встановлення динамічної рівноваги, кількість молекул, які прилипають до стінки і які її покидають стають однаковими. Молекула, покидаючи стінку, передає їй імпульс mV. Таким чином і в цьому випадку загальна зміна імпульсу теж буде дорівнювати 2mV, тобто немає різниці, та ж молекула покинула стінку, чи інша. Запишемо другий закон Ньютона і знайдемо тиск Р
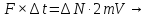
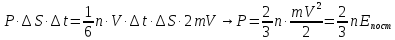 (6.2)
(6.2)
Реально швидкості молекул різні. Розбивши всі молекули на групи з однаковими швидкостями, парціальний тиск кожної групи молекул знаходиться по формулі (6.2). Скориставшись законом Дальтона, знайдемо загальний тиск
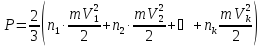 .
.
У
дужках записана загальна енергія
поступального руху всіх молекул. Її
можна знайти ще як добуток концентрації
молекул n
на середню енергію поступального руху
 , де середня
квадратична швидкість – це корінь
квадратний із середнього значення
квадратів швидкостей усіх N
молекул (риска зверху означає середнє
значення)
, де середня
квадратична швидкість – це корінь
квадратний із середнього значення
квадратів швидкостей усіх N
молекул (риска зверху означає середнє
значення)
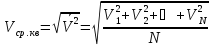
.
Таким чином, основне рівняння молекулярно-кінетичної теорії має вид
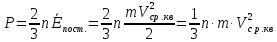 .
(6.3)
.
(6.3)
-
Середня енергія поступального руху молекул. Молекулярно-кінетичне тлумачення температури
Підставимо тиск (6.3) в рівняння (6.1) Клапейрона-Менделєєва
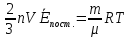 .
(6.4)
.
(6.4)
Знаходимо середню енергію поступального руху
 .
(6.5)
.
(6.5)
Тут: NA = 6,02∙1023 1/моль – число Авогадро,
![]() –
стала
Больцмана.
–
стала
Больцмана.
Вираз (6.5) показує, що середня енергія поступального руху молекул залежить тільки від абсолютної температури і не залежить від типу молекул. Тому абсолютну температуру трактують як міру кінетичної енергії теплового руху молекул. Так як кінетична енергія не може бути від’ємною, то і абсолютна температура Т завжди позитивна.
Підстановка (6.5) в (6.4) дає такий вираз основного рівняння молекулярно-кінетичної теорії:
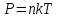 .
(6.6)
.
(6.6)
Видно,
що тиск газу не залежить від маси (типу)
молекул, а визначається тільки їх
концентрацією і температурою. Тому
очевидним стає закон Дальтона
 .
.
