- •2.Современное состояние и тенденции развития мировой энергетики.
- •3.Основные положения гидростатики: полное гидростатическое давление в точке, выражение гидростатического напора, сила действующая на плоскую поверхность в жидкости.
- •Уравнение неразрывности потока.
- •Режимы течения жидкости. Критерий Рейнольдса.
- •Уравнение Бернулли.
- •8.Потеря напора в потоке.
- •9.Предмет и методы термодинамики. Понятия термодинамики: термодинамическая система, рабочее тело, реальный газ, идеальный газ.
- •10. Теплота и работа.
- •11.Параметры состояния, их систематизация.
- •12.Основные параметры состояния, уравнения состояния газа.
- •13.Теплоемкость.
- •14. Понятие термодинамического процесса. Равновесный и неравновесный, обратимый и необратимый процессы.
- •16. Внутренняя энергия и энтальпия- калорические параметры вещества.
- •17. Первый закон термодинамики.
- •18.Энтропия, её физический смысл и свойства.
- •19. Расчетные зависимости изменения энтропии в различных процессах.Ts диаграмма.
- •20. Круговые термодинамические процессы.
- •21. Цикл Карно- идеальный цикл теплового двигателя.
- •22. Второй закон термодинамики.
- •23. Эксергия, её понятия и основные расчетные зависимости.
- •24. Водяной пар. Насыщенный, сухой насыщенный, перегретый пар. Степень сухости пара. Удельная теплота парообразования. Тройная точка воды. Критическое состояние воды.
- •25. Диаграммы и таблицы водяного пара.
- •26. Газотурбинная установка. Цикл Брайтона.
- •27. Паротурбинная установка. Цикл Ренкина.
- •28. Анализ цикла Ренкина с учетом потерь от необратимости.
- •29. Паротурбинная установка с промежуточным перегревом пара.
- •30. Паротурбинная установка с регенеративным подогревом питательной воды.
- •31. Теплофикационные паротурбинные установки.
- •32. Показатели эффективности теплофикации.
- •33. Парогазовые установки.
- •34. Теплосиловая установка с магнитогидродинамическим генератором.
- •35. Теплопроводность- один из видов теплопереноса. Температурное поле.
- •36. Закон Фурье- основной закон теплопроводности. Коэффициент теплопроводности.
- •37. Конвективный теплообмен. Теплоотдача. Закон Ньютона- Рихмана.
- •38. Теплообмен излучением. Основные положения теории электромагнитного излучения.
- •39. Основные законы теплового излучения: Планка, смещения Вина, Стефана- Больцмана, Ламберта, Кирхгофа.
- •40. Теплообменные устройства, их классификация. Рекуперативные теплообменные аппараты.
- •41. Регенеративные и смесительные теплообменные аппараты.
- •42. Энергетическое топливо. Основные виды топлив, их сравнительная характеристика.
- •43. Технические характеристики топлив.
- •44. Классификация углей.
- •45. Марки мазутов.
- •46. Газообразное топливо.
- •47. Физико- химические основы процесса горения.
- •48. Топочные устройства, их классификация ,рабочие характеристики.
- •49. Пылеугольные топки.
- •50. Технологическая схема производства пара на тэс.
- •52.Водогрейные котлы.
- •53. Тепловой процесс в турбинной ступени. Степень реактивности турбинной ступени.
- •54. Активные и реактивные паровые турбины. Конструкция полуреактивной турбины.
- •55. Классификация, маркировка, структурные схемы паровых турбин.
- •56. Особенности газовых турбин в сравнении с паровыми.
- •57. Физические основы атомной энергетики.
- •58. Активная зона ядерного реактора . Тепловыделяющий элемент.
- •59. Уран- графитовый ядерный реактор канального типа.
- •60. Водо- водяной энергетический реактор.
- •63. Современное состояние атомной энергетики.
- •64. Современное состояние гидроэнергетики.
- •65. Основные понятия гидрологии рек: расход, сток, норма расхода, норма стока, гидрограф.
- •66. Работа водного потока. Схемы концентрации напора: плотинная, деривационная.
- •67. Гидравлические турбины, их классификация, конструкции.
- •68. Основные сооружения гэс: плотины, здания и др. Особенности Красноярской и сшгэс.
- •69. Малая гидроэнергетика.
- •70. Гидроаккумулирующие гидроэлектростанции.
- •71. Приливные электростанции.
- •72. Совместная работа тэс, аэс ,гэс в энергетической системе.
- •73. Нетрадиционные и возобновляемые источники энергии.
- •74. Солнечная энергетика.
- •75. Ветроэнергетика.
- •77. Энергия биомассы. Энергия морских волн.
- •1.Предмет общей энергетики, основные понятия и определения.
- •2.Современное состояние и тенденции развития мировой энергетики.
- •3.Основные положения гидростатики: полное гидростатическое давление в точке, выражение гидростатического напора, сила действующая на плоскую поверхность в жидкости.
16. Внутренняя энергия и энтальпия- калорические параметры вещества.
Внутренняя энергия существует внутри тела.
![]()
![]() -внутренняя
энергия.
-внутренняя
энергия.
Составляющие внутренней энергии:
-
совокупность кинетической энергии микрочастиц.
-
потенциальная энергия взаимодействия микрочастиц.
-
энергия электронных оболочек атомов.
-
внутриядерная энергия.
Величина внутренней энергии определяется состоянием внутренней энергии – поэтому внутреннюю энергию называют функцией состояния.
Изменение внутренней энергии в термодинамическом процессе не зависит от пути процесса, зависит от исходного и конечного состояния системы.
![]()
![]()
Для идеального газа внутренняя энергия зависит только от температуры.
![]() ;
;
![]()
Энтальпия представляет собой сумму внутренней энергии и потенциальной энергии, внешнего давления.
![]() ;
;
![]()
Энтальпия есть функция состояния.
17. Первый закон термодинамики.
Первый закон термодинамики является частным случаем закона сохранения энергии: теплота, подведенная к термодинамической системе, расходуется на увеличение внутренней энергии и совершение работы.
Аналитические выражения первого закона термодинамики:
![]() -
дифференциальная форма
-
дифференциальная форма
![]() -для
конечного процесса ,на 1 кг вещества
-для
конечного процесса ,на 1 кг вещества
![]() ,-
для произвольного количества вещества
,-
для произвольного количества вещества
![]() для
бесконечно малого процесса.
для
бесконечно малого процесса.
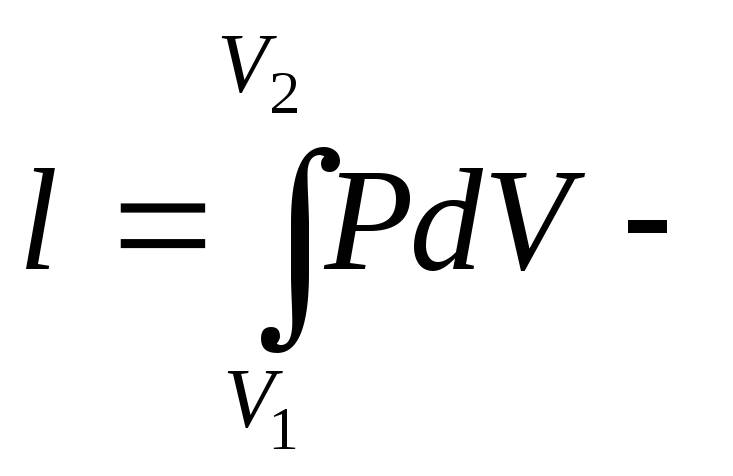 работа
изменения объема
работа
изменения объема
Выведем уравнение первого закона термодинамики во второй форме, то есть через энтальпию:
![]()
![]() для
элементарного процесса.
для
элементарного процесса.
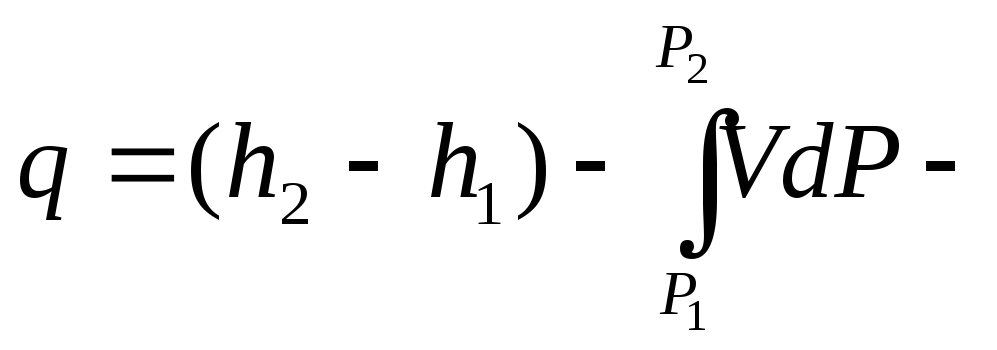 для
конечного процесса
для
конечного процесса
18.Энтропия, её физический смысл и свойства.
Энтропия есть мера деградации энергии, мера рассеяния энергии.
S, Дж/К
Увеличение энтропии термодинамической системы в элементарном обратимом процессе.
![]() ,
,
где
![]() теплота,
передаваемая термодинамической системе.
теплота,
передаваемая термодинамической системе.
![]() температура.
температура.
Приращение энергии в конечном обратимом процессе.
![]()
Свойства энтропии:
-Энтропия изолированной системы не изменяется, когда в системе протекают обратимые процессы.
-Энтропия возрастает, когда в системе протекают необратимые процессы.
-Переход термодинамической системы от неравновесного состояния к равновесному, сопровождается ростом энтропии.
-В равновесном состоянии энтропия достигает максимума.
-Энтропия сложной системы равна сумме энтропий компонентов.
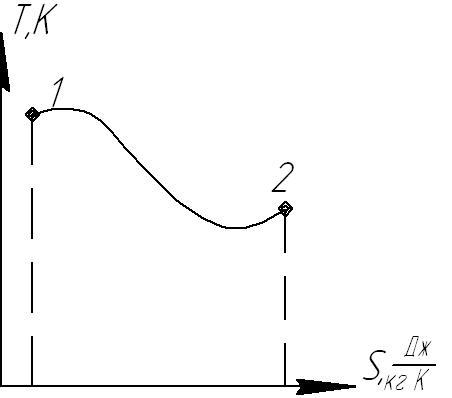
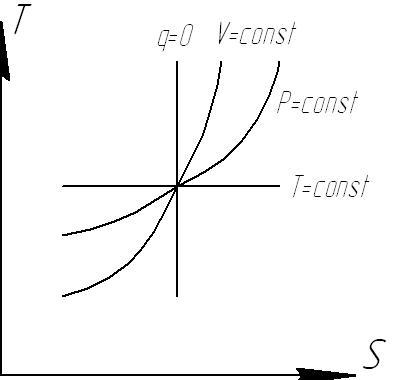
19. Расчетные зависимости изменения энтропии в различных процессах.Ts диаграмма.
-
изохорный процесс
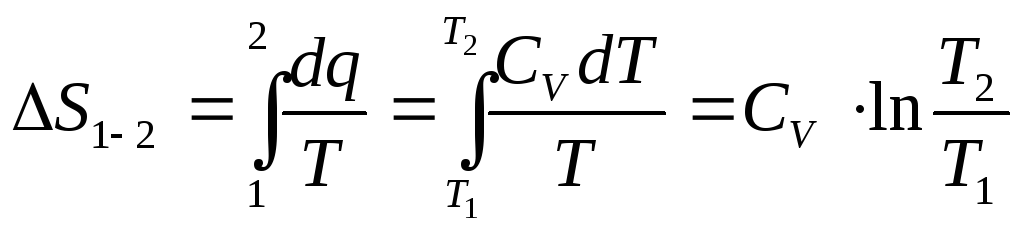
-
изобарный процесс
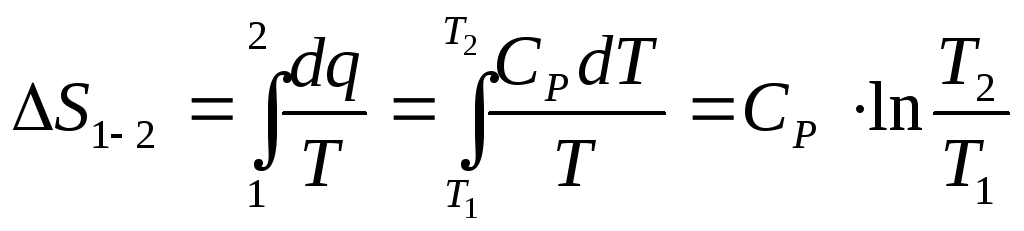
-
изотермический процесс
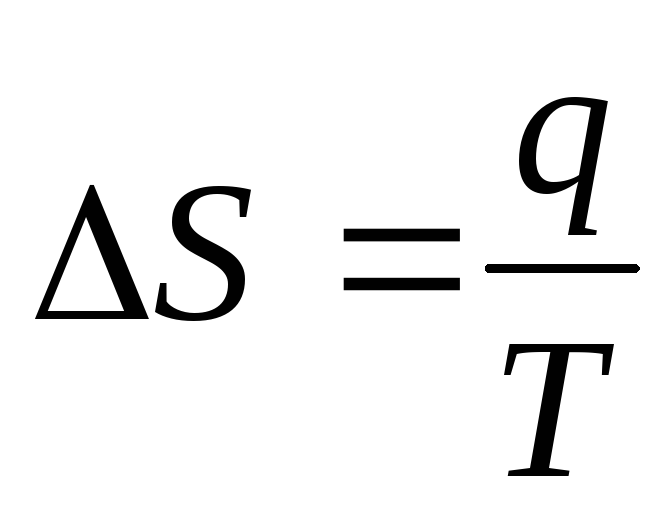
-
адиабатный обратимый процесс
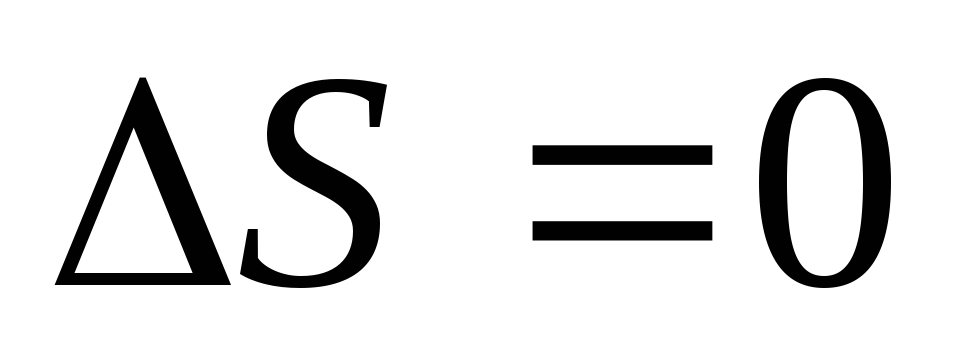
-
политропный процесс
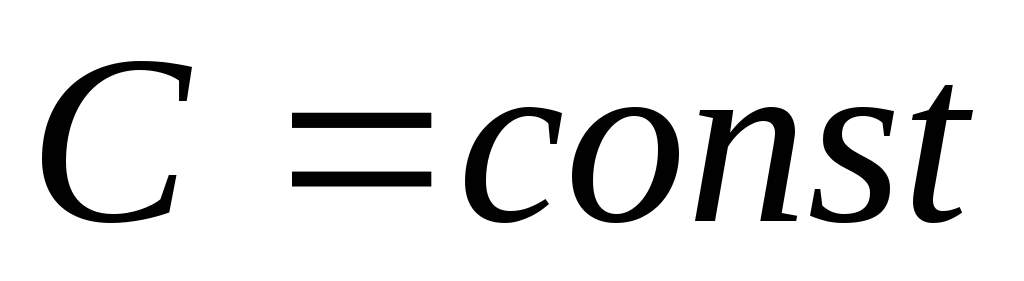 ;
;
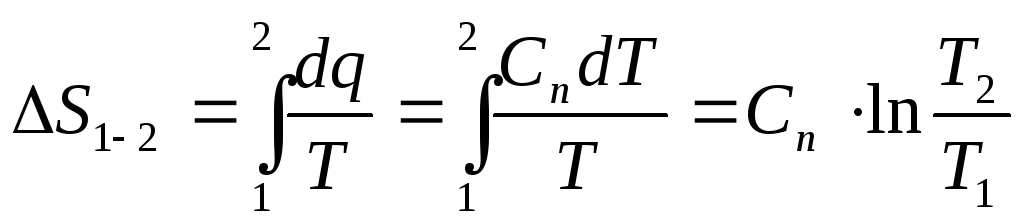
Изменение энтропии идеального газа:
![]()
изменение энтропии газа через другие основные параметры состояния:
![]() ;
;
![]()
Если условно принять уровень отсчета на котором энтропия равна нулю, то, пользуясь формулами можно вычислить абсолютную энтропию в любом состоянии термодинамической системы. За уровень отсчета обычно принимают нормальные условия.
![]() ;
;
![]() ;
;
![]()
![]() диаграмма
диаграмма