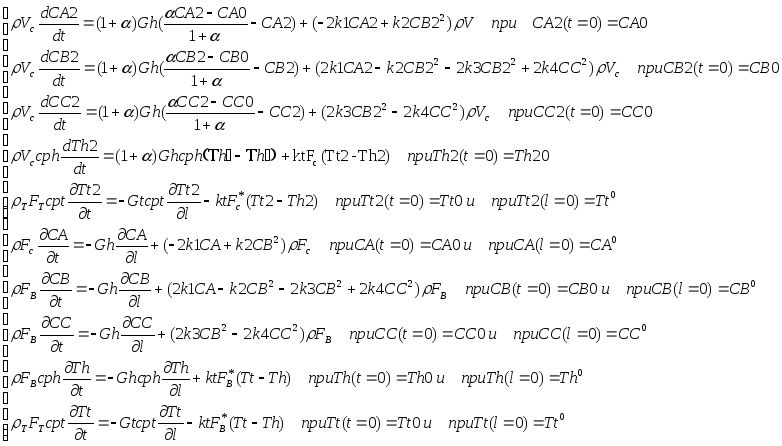Zadanie_7_Metodich_material_po_MMKhR
.doc
Методический материал по теме «Моделирование реакторов химико-технологических процессов»
Часть 1. Составление дифференциальных уравнений для химического реактора.
Задание. (Вар. 14 мет.214 стр.33.)
Химическая реакция A![]() 2B
2B![]() 2C
проводится в реакторе, гидродинамический
режим в котором описывается следующей
моделью:
2C
проводится в реакторе, гидродинамический
режим в котором описывается следующей
моделью:
Процесс протекает изотермически. Поэтому для поддержания приемлемой скорости химического превращения производится подогрев реакционной смеси с помощью встроенного в аппарат змеевика. Построить математическую модель ХТП.
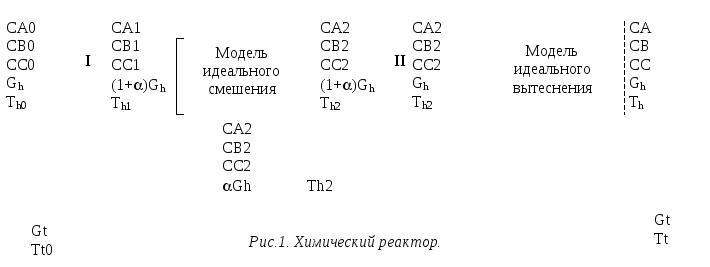
Решение. Математическую модель строим в отдельности для каждого элемента (рис.1).
1.РАССМОТРИМ ОТДЕЛЬНО ЗОНУ МОДЕЛИ ИДЕАЛЬНОГО СМЕШЕНИЯ (рис.2).

Рис.2. Зона идеального смешения
a) Скорости реакций по веществам А, B, C для этой зоны имеют вид:
A= –2k1CA2+k2CB22
B=2k1CA2 – k2CB22 – 2k3CB22 + 2k4CC22
C=2k3CB22 – 2k4CC22
b) Уравнение материального баланса:
M=Mвхt-MвыхtMхрt.
Раскроем слагаемые:
M=·Vс·CA2
Mвх=(1+)·Gh·CA1
Mвых=(1+)·Gh·CA2
Mхр=+A··Vс
Тогда после подстановки имеем:
·Vс·CA2=(1+)·Gh·(СА1-CA2)·t+A··Vс·t
при tdt имеем:
·Vс·dCA2/dt=(1+)·Gh·(СА1-CA2)+A··Vс
после подстановки скорости реакции A:
![]()
Для того чтобы избавится от концентрации СA1 составим материальный баланс для точки I (рис.1.):
·Gh·CA2+Gh·CA0=(1+)·Gh·CA1 тогда CA1=(·CA2-CA0)/(1+).
Подставив в дифференциальное уравнение:
![]() (1)
(1)
Дублируем дифференциальное уравнение этой зоны для веществ B и C, учитывая скорости реакций:
![]() (2)
(2)
![]() (3)
(3)
c) Уравнения теплового баланса для зоны идеального смешения:
Q=Qвхt-QвыхtQхрt+Qтоt
Раскроем слагаемые:
Q=·V·Сph·Th2
Qвх=(1+)·Gh Сph Th1
Qвых=(1+)·Gh Сph Th2
Qхр=0 (реакция изотермическая)
Qто=kt·Fc·(Tt2-Th2)
Тогда после подстановки имеем:
·V·Сph·Th2=(1+)·GhСph·(Th1-Th2)·t+ kt·Fc·(Tt2-Th2)·t
при tdt имеем:
![]() (4)
(4)
Для змеевика уравнение теплового баланса как для идеального вытеснения:
Q=Qвхt – Qвыхt + Qтоt
Раскроем слагаемые:
Q=T·V·СpТ·Tt2=T ·FT·l·СpТ·Tt2
Qвх=GТ СpТ Tt2
Qвых=GТ СpТ (Tt2+Tt2)
Qто= –kt·Fc·(Tt2-Th2)
Тогда после подстановки имеем:
T ·FT·l СpТ Tt2= Gt СpТ Tt2t – Gt СpТ (Tt2+Tt2)t – kt·Fc·(Tt2-Th2)·t
при tdt а также при ldl имеем:
![]()
где Fc*=Fc/l –удельная площадь теплообмена (5)
Итак, составлены уравнения (1)-(5) для материальных и тепловых балансов зоны смешения. Уравнения дополняются начальными условиями:
CA2(t=0)=CA0 CB2(t=0)=CB0 CC2(t=0)=CC0 Th2(t=0)=Th0 Tt2(t=0)=Tt0
и граничными условиями: Tt2(l=0)=Tt0.
2. РАССМОТРИМ ОТДЕЛЬНО ЗОНУ МОДЕЛИ ИДЕАЛЬНОГО ВЫТЕСНЕНИЯ (рис.3).

Рис.3. Зона идеального вытеснения
a) Скорости реакций по веществам А, B, C для этой зоны имеют вид:
A= –2k1CA+k2CB2
B=2k1CA – k2CB2-2k3CB2+2k4CC2
C=2k3CB2 – 2k4CC2
b) Уравнение материального баланса:
M=Mвхt-MвыхtMхрt
Раскроем слагаемые:
M=·FВ·l·CA
Mвх=Gh·CA
Mвых=Gh·(CA+CA)
Mхр=+A··FВ·l
Тогда после подстановки имеем:
·FВ·l·CA=Gh·СА-Gh·(CA+CA)·t+A··FВ·l·t
при tdt а также при ldl и после подстановки Aимеем:
![]() (6)
(6)
Дублируем дифференциальное уравнение этой зоны для веществ B и C, учитывая скорости реакций:
![]() (7)
(7)
![]() (8)
(8)
c) Уравнения теплового баланса для зоны идеального вытеснения:
Q=Qвхt-QвыхtQхрt+Qтоt выводятся аналогично пункту 1с. Имеем:
![]() (9)
(9)
![]() (10)
(10)
Итак, составлены уравнения (6)–(10) для материальных и тепловых балансов зоны вытеснения. Уравнения дополняются начальными условиями:
CA(t=0)=CA0 CB(t=0)=CB0 CC(t=0)=CC0 Th2(t=0)=Th0 Tt2(t=0)=Tt0
и граничными условиями:
Th2(l=0)=Th0=Th0; Tt2(l=0)=Tt0=Tt0.
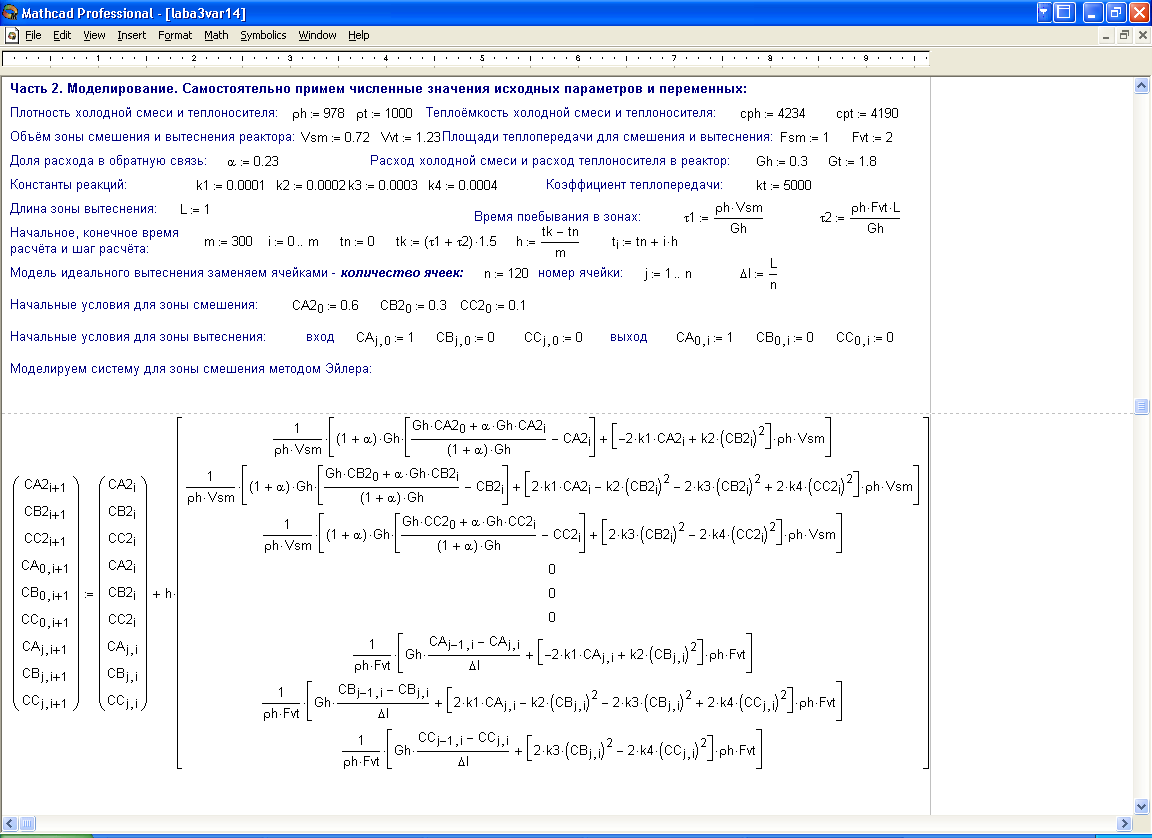
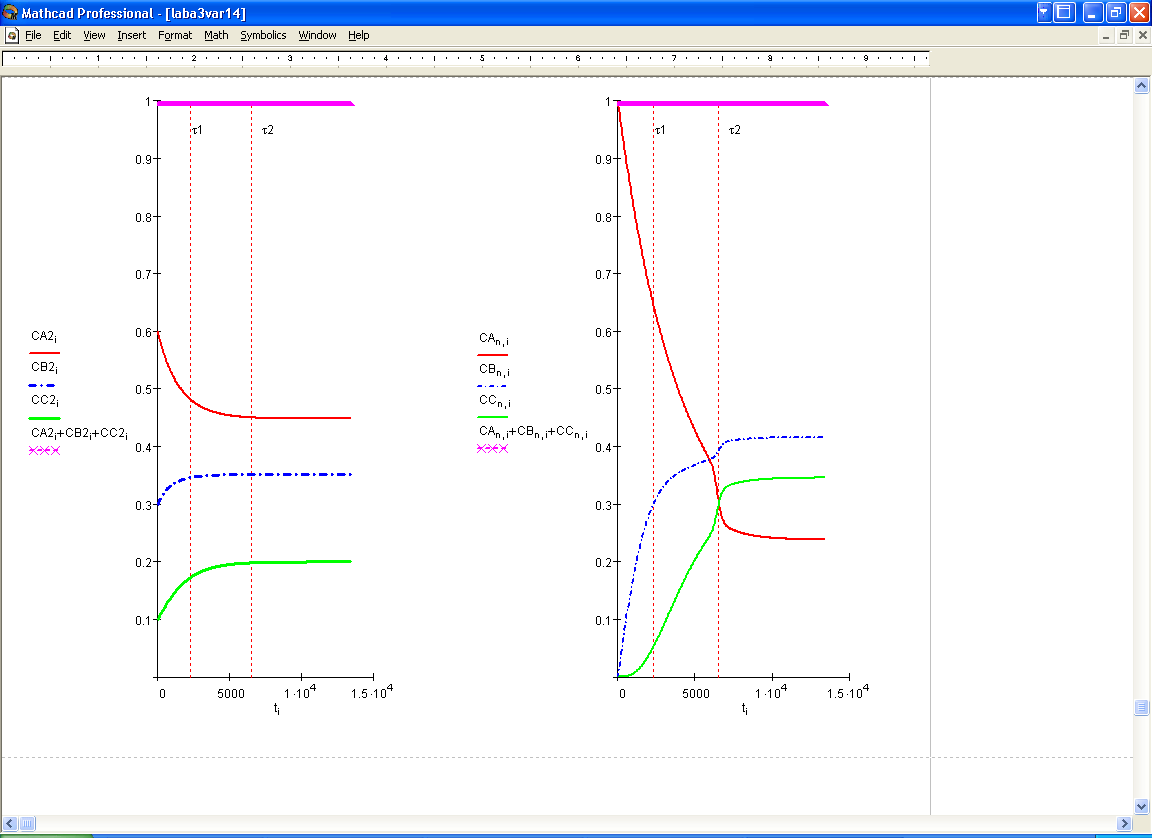
3. В ИТОГЕ МАТЕМАТИЧЕСКАЯ МОДЕЛЬ РЕАКТОРА ИМЕЕТ ВИД: