
Zadanie_5_Metod_mater-kinetika
.doc
Методический материал по теме «Моделирование кинетики сложных химических реакций»
Будем рассматривать область химической технологии – кинетику сложных химических реакций. Рассмотрим основные понятия химической кинетики.
Для реакций, идущих при постоянном объёме в замкнутой системе, скорость химической реакции есть изменение концентрации С (уменьшение либо увеличение) в единицу времени: =dC/dt. Знак (+) показывает, что в реакции накапливается вещество, знак (–) что концентрация вещества снижается.
Скорость реакции согласно закону
действующих масс (з.к.м.) пропорциональна
наличной концентрации реагирующих
веществ. Так для реакции
![]() скорость реакции равна:
скорость реакции равна:
![]() где k– коэффициент
пропорциональности или константа
химической реакции [сек-1]. Для
данного вида молекул константа скорости
химической реакции обычно представляется
в виде законе Аррениуса:
где k– коэффициент
пропорциональности или константа
химической реакции [сек-1]. Для
данного вида молекул константа скорости
химической реакции обычно представляется
в виде законе Аррениуса:
![]() где k0 –
множитель, зависящий от количества
столкновений молекул; E-
энергия активации; R
– универсальная газовая постоянная;
T-абсолютная температура.
где k0 –
множитель, зависящий от количества
столкновений молекул; E-
энергия активации; R
– универсальная газовая постоянная;
T-абсолютная температура.
Молекулярность характеризует число молекул, участвующих в реакции в соответствии со стехиометрическим уравнением. Молекулярность может выражаться только целыми числами. Различают мономолекулярные, бимолекулярные и многомолекулярные реакции. Реакция будет элементарной, если она протекает в одну стадию и имеется соответствие между стехиометрическим соотношением и уравнением скорости. Если такого соответствия нет, то реакция не будет элементарной.
Показатели степени при концентрациях реагирующих веществ в уравнении скорости реакции называются порядками реакции по соответствующим исходным веществам, а сумма этих показателей степеней – суммарным порядком реакции. Для реакции первого порядка скорость реакции пропорциональна концентрации одного реагента, для реакции второго порядка – произведению концентраций двух реагентов, для реакции третьего порядка– произведению концентраций трёх реагентов.
Молекулярность и порядок реакции часто
не совпадают из-за того, что реакции
слагаются из последовательно идущих с
различной скоростью стадий, либо
вследствие большого различия концентраций.
Так, например, реакция первого порядка
может быть мономолекулярной
![]() или бимолекулярной
или бимолекулярной
![]() (в последнем случае один реагент, например
B, взят в большом
избытке и его концентрация в ходе реакции
остаётся практически постоянной).
(в последнем случае один реагент, например
B, взят в большом
избытке и его концентрация в ходе реакции
остаётся практически постоянной).
Скорость реакции многих компонентов при неизвестном механизме часто аппроксимируется уравнением:
![]()
где а – порядок реакции по компоненту А, b – порядок реакции по компоненту B, с – порядок реакции по компоненту С, …, p – порядок реакции по компоненту P. Порядок реакции может быть и дробным и находится опытным путём.
Выбор ключевых компонентов применяется для снижения порядка математической модели (т.е., например, описывали химическую систему 6 уравнениями, выразили 3 не основных компонента через 3 основных «ключевых» компонента и получили систему только из 3-х уравнений, которую решать легче). При современном развитии вычислительной техники можно решать системы очень высоких порядков. Поэтому выбор ключевых компонентов часто применяют при решении вручную.
Константа равновесия обратимых химических реакций. Реакции часто протекают в прямом и в обратном направлении (обратимые реакции). В этом случае не достигается полного превращения исходных компонентов (константа скорости k1) и реакция идёт в обратном направлении (константа скорости k2):
![]()
При этом устанавливается равновесие, определяемое величиной константы равновесия KC. Согласно з.д.м. при состоянии равновесия справедливо соотношение:
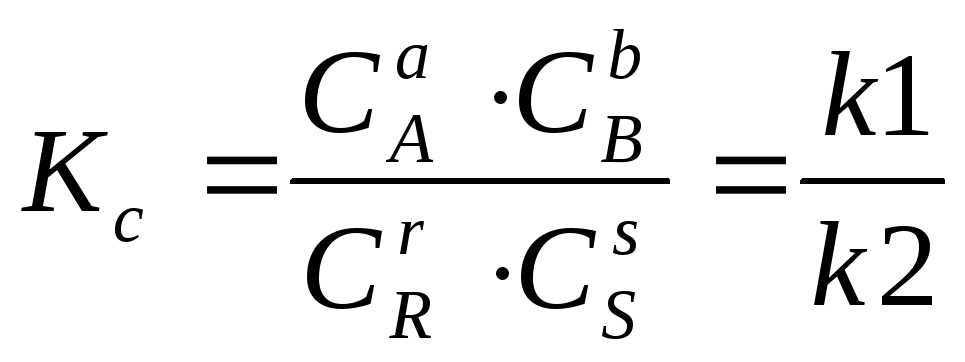
Рассмотрим пример численного решения системы обыкновенных дифференциальных уравнений при моделировании кинетики химических реакций.
Задание. Для химической реакции, в которой участвуют 4 реагента и проходящей в два этапа построить переходные процессы изменения концентраций всех четырех компонентов во времени. Заданы константы скоростей реакций: k1=0.1; k2=1; k3=0.8; k4=1.1; и начальные значения концентраций: CA0=0.7; CB0=0.2; CC0=0.05; CD0=0.05.
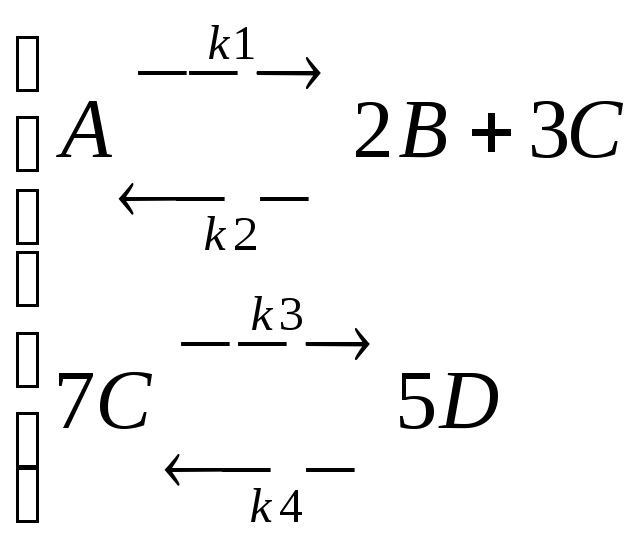
Решение
Задача моделирования кинетики химической реакции решается в два этапа. На первом этапе необходимо составить систему дифференциальных уравнений, которые описывают сложную обратимую химическую реакцию. Особенности составления дифференциальных уравнений химической кинетики представлены на рис.9.
Часть 1. Составление дифференциальных уравнений.
В соответствии с построением кинетических уравнений скорости реакций:
![]()
![]()
![]()
![]()
Составим дифференциальные уравнения для каждого вещества:
Вещество А) Первая химическая реакция идёт от вещества А к 3С,
первая химическая реакция идёт от вещества А к 2В,
вторая химическая реакция идёт к 1А (от В),
вторая химическая реакция идёт к 1А (от С)
![]()
Вещество В) Первая химическая реакция идёт к 2В,
вторая химическая реакция идёт от вещества В к 1А
![]()
Вещество С) Первая химическая реакция идёт к 3С,
вторая химическая реакция идёт от С к 1А,
третья химическая реакция идёт от С к 5D,
четвёртая химическая реакция идёт к 7С
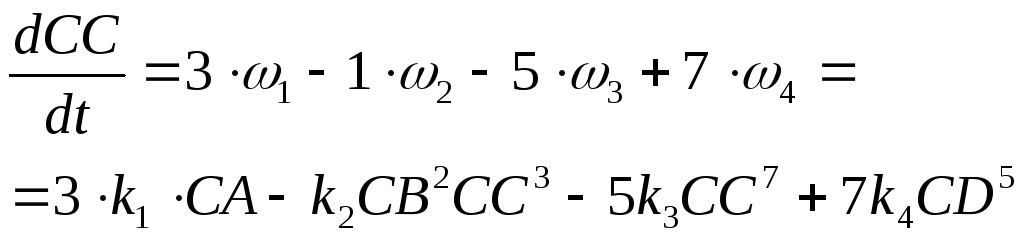
Вещество D) Третья химическая реакция идёт к 5D,
Четвёртая химическая реакция от D к 7С
![]()
Проверка составления. Сумма концентраций в замкнутой системе равна единице: СА+СВ+СС+СD=1. Взяв производную по времени имеем:
![]()
Сложим первое, второе, третье и четвёртое дифференциальные уравнения:
|
k1 |
-5+2+3=0 |
|
k2 |
2-1-1=0 |
|
k3 |
-5+5=0 |
|
k4 |
7-7=0 |
Проверка сходится – система дифференциальных уравнений составлена верно.
Вторая часть лабораторной работы заключается непосредственно в моделировании изменения концентрации всех реагентов во времени. Моделирование показано на рис. А.
 Рис.
А. Моделирование кинетики сложной
обратимой химической реакции.
Рис.
А. Моделирование кинетики сложной
обратимой химической реакции.
