
Статья взята с официального сайта “New England Journal of Medicine” – nejm.org
Оригинальная статья находится по ссылке: http://www.nejm.org/doi/full/10.1056/NEJMcps062601
Перевод выполнил студент Коновод И. А. (ник на форуме pedis.ru – “Эль-Кано”)
Clinical Problem-Solving
A Stitch in Time
Christopher J. Graber, M.D., M.P.H., Adam S. Lauring, M.D., Ph.D., and Peter V. Chin-Hong, M.D.
N Engl J Med 2007; 357:1029-1034September 6, 2007
В данной статье авторы постадийно описывают реальный клинический случай эксперту-клиницисту (жирный шрифт), который, в свою очередь, делится с читателями своими рассуждениями о представленной информации (обычный шрифт). Далее следуют комментарии авторов.
Пациент 64 лет, длительное время страдающий ИБС и атеросклерозом периферических артерий, поступил с жалобами на лихорадку, эпизоды озноба и быструю утомляемость при физической нагрузке, которые продолжались в течение нескольких месяцев. Симптомы возникли 10 месяцев назад, после того, как пациенту было выполнено чрескожное эндоваскулярное стентирование передней нисходящей коронарной артерии. Пациенту был проведен 5-дневный курс эмпирической терапии ципрофлоксацином, приведший к временному клиническому улучшению. Однако через 1 неделю после окончания курса антибиотикотерапии симптомы возникли снова, и 3 недели спустя пациент был госпитализирован в областной стационар. При посеве крови был получен рост стрептококка группы С. При трансторакальной эхокардиографии патологии не выявлено. При коронарографии обнаружен рестеноз стента передней нисходящей коронарной артерии, было выполнено повторное стентирование. Была проведена терапия антибиотиками широкого спектра действия, после чего пациент был выписан с указаниями закончить 6-недельный курс терапии цефтриаксоном.
Эксперт:
Клинические проявления у пациента появились через небольшой промежуток времени после того, как он подвергся катетеризации кровеносных сосудов. Правда инфицирование коронарных стентов встречается чрезвычайно редко, но мне интересно, не была ли во время процедуры занесена эндоваскулярная инфекция? Оптимальной тактикой ведения этого пациента при первом поступлении было бы выполнение посева крови с последующей терапией ципрофлоксацином. Стрептококк группы С в норме колонизирует ротовую полость и желудочно-кишечный тракт и редко становиться патогенным для человека, однако есть описания эндокардитов, вызванных этим микроорганизмом, а также тяжелого токсин-опосредованного септического синдрома, сходного с вызываемым стрептококком группы А. Учитывая подозрение на наличие эндоваскулярной инфекции, я бы настоятельно рекомендовал выполнить трансэзофагеальную эхокардиографию, чтобы провести диагностику эндокардита.
После выписки из стационара клинические проявления отсутствовали на протяжении всего курса антибиотикотерапии. Однако через 1 месяц после окончания приема антибиотиков, пациент сообщил о возвращении быстрой утомляемости, недомогания и небольшой лихорадки. На протяжении последующих 7 недель пациент получил амбулаторно несколько курсов антибактериальной терапии, использовались следующие препараты: триметоприм-сульфаметоксазол, доксициклин и цефалексин – однако ни один из них не привел к улучшению состояния. После окончания приема антибиотиков была выполнена серия посевов крови, шесть из них, взятых течение 3 дней, дали рост Enterococcus faecalis. С целью определения источника бактериемии пациенту было проведено комплексное обследование, включавшее трансторакальную ЭхоКг, КТ брюшной полости и малого таза, дуплексное УЗИ обеих нижних конечностей, сцинтиграфию с меченными изотопом индия лейкоцитами, рентгенологическое исследование тонкой кишки с бариевым контрастом, эзофагогастродуоденоскопию и колоноскопию, но ни один из этих методов патологии не выявил. Пациент был снова госпитализирован, в течение 4-6 недель получал внутривенно ампициллин, затем, так как он попросил уменьшить частоту приема антибиотиков, был выписан и 6 дней принимал ванкомицин. На фоне приема ванкомицина пациент снова стал отмечать появление недомогания и лихорадки, вдобавок появилась одышка при физической нагрузке. Был заново госпитализирован, ванкомицин был отменен, и пациента перевели в данный стационар для дальнейшего обследования и лечения.
Эксперт:
Когда после прекращения приема цефтриаксона у пациента снова появились симптомы, лучше всего было бы выполнить заново посев крови до начала повторной эмпирической терапии. E. faecalis, относящийся к обитающим в пищеварительном тракте комменсалам, часто оказывается причиной развития эндокардита, причем нередко имеющего вялое течение. Тот факт, что ряд посевов крови, проведенных в различные дни, показал рост нескольких видов микроорганизмов, свидетельствует в пользу эндоваскулярного источника инфекции. С учетом всего этого, а в особенности наличия роста в предшествующих культурах крови стрептококка группы С, пациенту показано проведение обследования желудочно-кишечного тракта. Также показано выполнение чреспищеводной ЭхоКГ для более точной диагностики эндокардита. Оптимальная схема терапии вызванной энтерококками эндоваскулярной инфекции включает применение ампициллина и гентамицина, и я назначил бы оба эти антибиотика еще до получения результатов исследований на чувствительность.
Кроме двух стентирований передней нисходящей коронарной артерии за 7 и за 10 месяцев до поступления, пациент также подвергался обходному шунтированию коронарной артерии 20 годами ранее и ангиопластике передней нисходящей коронарной артерии 7 годами ранее. За 17 месяцев до поступления пациенту было выполнено бедренно-подколенное и двустороннее аорто-бедренное шунтирование в сочетании с установкой стента в правую бедренную артерию. Сопутствующие заболевания: застойная сердечная недостаточность легкой степени тяжести, сахарный диабет 2 типа, гиперлипидемия и гастроэзофагеальная рефлюксная болезнь. Пациент принимал фуросемид, инсулин, глипизид, аспирин, пантопразол и симвастатин. В семейном анамнезе было отмечено раннее начало коронарной болезни сердца у его отца и брата. Стаж курения – 75 пачек/лет, продолжал курить. Со слов пациента, алкоголь принимал изредка.
Эксперт:
Следует рассмотреть возможность формирования очага эндоваскулярной инфекции в аорто-бедренном или бедренно-подколенном шунтах, так как результаты проведенных исследований не исключают этой возможности. При физикальном обследовании я искал бы признаки эндоваскулярной инфекции (пятна Рота, петехии на слизистых, линейные геморрагии, узелки Ослера и очаги Джейнуэя), расположение которых может оказаться ключом к установлению локализации очага инфекции. К примеру, на расположенный ниже сердца источник инфекции, такой как инфицированный аортальный графт, указывало бы наличие очагов на одной или обеих ногах при отсутствии высыпаний на руках.
При физикальном обследовании:
Температура тела – 37,7°С, АД – 157/57 мм Hg, ЧСС – 75/мин, ЧДД – 16/мин, SaO2 – 96% при дыхании атмосферным воздухом. Пациент выглядел нездоровым, но не имеющим острого заболевания (в оригинале – The patient appeared to be uncomfortable but not in acute distress; прим. перев.). При аускультации – жесткое дыхание с обеих сторон, скудные влажные хрипы над нижними отделами обоих легких. Яремное венозное давление – 15 см вод. ст. При аускультации сердца – регулярный ритм с нормальной частотой, выслушивается III тон, отмечается систолический ромбовидный шум с интенсивностью 2 из 6 (имеется в виду цифровая классификация интенсивности сердечных шумов от 1 до 6, предложенная Samuel Levine; прим. перев.), лучше выслушивающийся по левому краю грудины. Живот мягкий и безболезненный при пальпации, не вздут. При осмотре конечностей: в области правой локтевой ямки установлен венозный катетер, место установки безболезненно и без гиперемии. Отеков или петехий на нижних конечностях не обнаружено.
Эксперт:
Судя по данным осмотра, у пациента как минимум есть застойная сердечная недостаточность средней степени тяжести. За исключением систолического шума, который по своим характеристикам и локализации не похож на шум при регургитации, на физикальном обследовании обнаружено очень мало указывающих на эндокардит признаков. Однако, все же, у пациента есть симптомы застойной сердечной недостаточности, которая может отражать наличие вызванной эндокардитом клапанной патологии. Периферический венозный катетер, установленный у пациента, может быть источником интеркуррентной инфекции, хотя отсутствие гиперемии и болезненности в зоне его установки делает это предположение маловероятным.
Анализ крови:
Лейкоциты – 7,4×109/л, гематокрит – 28,1%, MCV – 92 фл, тромбоциты - 304×109/л, СОЭ – 91 мм/час. Лейкоцитарная формула определена не была. Данные предшествовавших анализов крови были недоступны, сравнение с полученными было невозможно. Уровень мочевины – 16 мг/дл (5,7 ммоль/л), креатинина – 1,5 мг/дл (133 мкмоль/л). Уровни электролитов и печеночных ферментов были в пределах нормы. Уровень тропонина I – 0,35 мкг/дл (норма < 0,5 мкг/дл), натрийуретического пептида В-типа – 1020 пг/мл (норма < 73 пг/мл).
На ЭКГ – нормальный синусовый ритм, признаки гипертрофии левого желудочка. Результаты анализа мочи – патологии нет. Рентгенограмма грудной клетки – умеренная кардиомегалия, легочные поля чистые.
Эксперт:
Наличие анемии у этого пациента требует проведения дальнейшего обследования, включающего анализы на уровень железа крови, так как возможна кровопотеря через желудочно-кишечный тракт. Кроме того, было бы полезно выполнить микроскопию мазка периферической крови на предмет признаков внутрисосудистого гемолиза, который часто обнаруживается у пациентов с эндокардитом на фоне пртезированных клапанов, но иногда может встречаться и у пациентов с эндокардитом на фоне нативных клапанов. Так как состояние пациента выглядит стабильным, я бы не начинал пока эмпирическую антибиотикотерапию, а выполнил бы еще хотя бы дважды посев крови.
При микроскопии мазка периферической крови патологии не выявлено. Исследования уровня железа не проводились. Был выполнен посев крови. На второй день, после того как во взятых при поступлении культурах крови был получен рост грам-отрицательных палочек, была начата терапия пиперациллином-тазобактамом. На третий день после госпитализации у пациента поднялась температура, поэтому антибиотик был сменен на имипенем. До начала терапии были выполнены несколько посевов крови. В одном из двух посевов, взятых при поступлении, был получен рост Enterobacter cloacae. В одной из двух культур, взятых в первый день госпитализации, был получен рост Bacillus cereus, E. cloacae, и Staphylococcus epidermidis. В одном из двух посевов, взятых на второй день, был получен рост E. cloacae, и в обоих – рост E. faecalis.
Эксперт:
Все микроорганизмы, высеянные из крови пациента, относятся к коменсалам пищеварительного тракта, что наводит на мысль о наличии сообщения между желудочно-кишечным трактом и кровотоком. Повторное появление E. faecalis в посевах крови служит дальнейшим подтверждением того, что у пациента может быть эндоваскулярная инфекция, не полностью вылеченная месяцем ранее. Серьезное подозрение на наличие эндоваскулярной инфекции, вероятное расположение источника бактериемии в желудочно-кишечном тракте, анемия у пациента – все это побуждает к скорейшему исследованию имплантированного аортобифеморального шунта. Кроме того, я бы порекомендовал удалить центральный венозный порт, так как источником всех этих микроорганизмов может быть также инфицированный катетер.
Центральный венозный катетер был удален; при посеве с кончика иглы полуколичественным методом роста не получено. Антибиотики изменены на ванкомицин и пиперациллин-тазобактам, к которым были чувствительны все высеянные бактерии. При контрольном посеве крови, проведенном на третий день лечения этими антибиотиками, роста не получено. Данные чреспищеводной эхокардиографии – функция желудочков не нарушена, умеренная кальцификация аортального клапана без выраженного стеноза или регургитации. Митральный, трикуспидальный и легочный клапаны без патологии, признаков вегетаций не было ни на одном из клапанов. Была выполнена магнитно-резонансная ангиография (МРА) брюшной полости и нижних конечностей, которая показала сохраненную проходимость аортобифеморального и бедренно-подколенного шунтов, а также отсутствие патологических изменений перипротезном пространстве.
Эксперт;
Отрицательные результаты посевов с кончика венозного катетера свидетельствуют против его инфицированности. Диагноз эндокардита тоже маловероятен из-за отрицательных результатов чреспищеводной эхокардиографии – метода исследования, имеющего высокую чувствительность в отношении этого заболевания. Кроме того, тогда было бы достаточно странно, что у пациента, поступившего с клиникой застойной сердечной недостаточности, практически нормальная эхокардиограмма. Обнаружение признаков инфицированности графтов на МРА позволило бы окончательно установить диагноз, однако отрицательные результаты этого исследования не исключают наличие аортокишечного свища.
При сцинтиграфии всего тела с меченными изотопом индия лейкоцитами не получено данных, которые указывали бы на очаг инфекции. В посеве крови, сделанном на 8 день, получен рост Candida albicans, начато лечение флуконазолом. При физикальном обследовании у пациента отмечено появление новых, болезненных петехий на правой стопе.
Эксперт:
Фунгемия часто развивается после терапии антибиотиками широкого спектра, так как эрадикация бактерий облегчает колонизацию и инвазию грибами рода Candida. Так как эти микроорганизмы также могут быть частью нормальной микрофлоры желудочно-кишечного тракта, высеивание их из крови вдобавок к бактериям-коменсалам пищеварительного тракта снова свидетельствует в пользу предположения о наличии сообщения между желудочно-кишечным трактом и сосудистым руслом. Обнаружение болезненных петехий на правой стопе служит подтверждением версии о локализующемся ниже сердца, протез-ассоциированном очаге эндоваскулярной инфекции. Я бы пригласил сосудистого хирурга, чтобы обсудить возможность диагностического оперативного вмешательства.
При КТ брюшной полости не обнаружено абсцессов или скоплений жидкости поблизости от аортобифеморального шунта. При повторной МРА не было выявлено явных признаков эндоваскулярной инфекции, но обнаружено прилегание проксимальной части аортобифеморального шунта к терминальному отделу двенадцатиперстной кишки (Рисунок 1). Четыре дня спустя пациент был направлен на диагностическую лапаротомию. Между терминальным отделом двенадцатиперстной кишки и пространством вокруг проксимального правого сегмента аортобифеморального шунта был обнаружен свищ 2×2 см (Рисунок 2). Внешняя поверхность проксимального правого сегмента протеза была окрашена желчью, наблюдалось эрозирование поверхности.
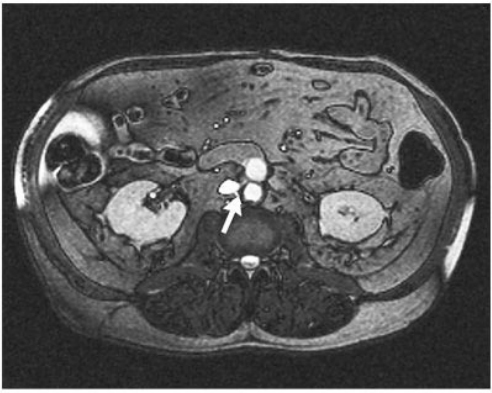
Рисунок 1. На магнитно-резонансной ангиограмме отмечается тесное прилегание аортального щунта-протеза к терминальному отделу двенадцатиперстной кишки (стрелка).

Рисунок 2. Схематичное изображение интраоперационного вида. Терминальный отдел двенадцатиперстной кишки отделен от шунта, поверхность протеза эрозирована, в стенке двенадцатиперстной кишки наблюдается дефект.
Явных признаков нагноения в этой области не было заметно, но отмечалось очень плотное спаивание протеза с окружающими тканями. Аортобифеморальный и бедренно-подколенный шунты были удалены, ушит дефект в стенке двенадцатиперстной кишки. Было заново выполнено двустороннее аорто-бедренное шунтирование криоконсервированным аллогенным трансплантатом бедренной вены с анастомозом конец-в-бок с брюшным отделом аорты, а также бедренно-подколенное шунтирование собственной большой подкожной веной пациента. Интраоперационно с удаленного аортобифеморального графта было взято несколько посевов, во всех из них был получен рост C. Albicans. Послеоперационный период осложнился острой почечной недостаточностью, потребовавшей проведения курса гемодиализа продолжительностью около 1 месяца, после чего пациент был выписан с незначительно повышенным уровнем креатинина. Пациент закончил 6-недельный курс лечения флуконазолом. Через 6 месяцев после операции состояние пациента было удовлетворительным.
Комментарии.
В этом клиническом наблюдении показано, что вначале установить диагноз рекуррентной бактериемии врачам было очень сложно, так как раз за разом не выполнялось посевов крови до начала антибактериальной терапии. Однако данные анамнеза о рецидивирующей, несмотря на атибиотикотерапию, невысокой лихорадке и недомогании, и, в конечном счете, многочисленные положительные результаты посевов крови, вызывали серьезное подозрение о наличие эндоваскулярной инфекции. Тот факт, что использованные эмпирически антибиотики не могла адекватно перекрыть весь спектр идентифицированных микроорганизмов, подчеркивает существование риска при применении подобного подхода. После того, как из нескольких культур крови были выделены микроорганизмы, обитающие в пищеварительном тракте, основное внимание было перенесено на желудочно-кишечный тракт и патологию аорты. В соответствии с правилом Байеса, снижение вероятности того или иного диагноза связано с увеличением вероятности альтернативного диагноза. Следовательно, так как отрицательные результаты рентгенологических, эндоскопических и сцинтиграфических методов исследований не позволяли предположить какой-либо альтернативный диагноз, наиболее вероятным стало предположение о аортокишечном свище. Таким образом, практически единственным основанием для выполнения пациенту диагностической лапаротомии стало, при соответствующих клинических условиях, наличие рекуррентной бактериемии.
Ключевым моментом для выяснения источника инфекции у пациентов с рецидивирующей бактериемией могут стать данные бактериологических исследований. Время от начала антибиотикотерапии, необходимое для получения стерильных посевов крови, может сильно варьировать в зависимости от тяжести заболевания, но даже в случае осложненного течения эндокардита уже через 1-2 недели следует ожидать исчезновение роста микроорганизмов в серийных посевах крови. Персистирование рекуррентной мономикробной бактериемии требует проведения обследования с целью выявления скрытого источника инфекции. У находящихся в стационаре пациентов к таким источникам относяться инфицированные постоянные катетеры или импланты, септические тромбофлебиты, а также другие очаги внутрисосудистой инфекции. Рекуррентная мультимикробная бактериемия указывает на другие клинические ситуации. Например, пациенты с тяжелым дефицитом функции комплемента восприимчивы к развитию бактериемии теми микроорганизмами, которые обладают капсулой, в частности Neisseria meningitidis и Streptococcus pneumonia. Рецидивирующая бактериемия, вызванная кишечной микрофлорой, наводит на мысль о нарушении целостности желудочно-кишечного тракта, что у этого пациента привело к инфицированию синтетического протеза.
Формирование аортокишечного свища является потенциально катастрофической клинической ситуацией. В зависимости от причины, аортокишечный свищ может быть первичным или вторичным. Первичный свищ может возникать у некоторых пациентов с аневризмой брюшного отдела аорты, вторичный встречается чаще и манифестирует как осложнение после оперативного вмешательства на аорте. Чаще всего свищ локализуется в горизонтальной или восходящей частях двенадцатиперстной кишки, так как они расположены ретроперитонеально и близко прилегают к аорте, однако свищ может наблюдаться также в пищеводе, тонком или толстом кишечнике. Операции, связанные с протезированием аорты осложняются формированием аортокишечного свища более чем в 2% наблюдений, причем летальность может превышать 50%. К факторам риска относятся: выполнение операции в экстренном или срочном порядке, расхождение швов или инфицирование раны в раннем послеоперационном периоде, перенесенные множественные оперативные вмешательства на кровеносных сосудах, а также невозможность отделить имплант и кишечник от большого сальника. Хотя первым признаком свища нередко бывает катастрофическое острое кровотечение, встречаются также случаи скрытого кровотечения, проявляющегося только железодефицитной анемией. У некоторых пациентов какие-либо признаки кровотечения могут отсутствовать. Аортокишечный свищ также может имитировать подострый бактериальный эндокардит, проявляясь невысокой лихорадкой, недомоганием и потерей веса.
Чтобы заподозрить данный диагноз, нужно иметь высокую степень настороженности в отношении этой патологии. При эндоскопическом исследовании верхней части желудочно-кишечного тракта можно обнаружить дефект стенки двенадцатиперстной кишки. При КТ брюшной полости с контрастированием можно выявить признаки перипротезного воспаления и инфицирования, а при КТ без контрастирования – установить наличие газа в пространстве между протезом и кишечником. Так как кровотечение может иметь интермиттирующий характер, чувствительность стандартной ангиографии ограничена. Сцинтиграфия с мечеными лейкоцитами позволяет обнаружить фистулу в более чем 80% случаев, но она имеет низкую чувствительность по отношению к неосложненным свищам, если нет выраженного инфицирования. Учитывая отсутствие у данного пациента вокруг свища заметного абсцесса, неудивительно, что результат этого исследования был отрицательным.
В большинстве случаев лечение включает в себя удаление протеза и всех инфицированных тканей, проведение реваскуляризации и закрытие кишечного свища. Данные относительно выбора препарата и продолжительности антибиотикотерапии ограничены; рекомендации обычно основаны на опыте лечения бактериального эндокардита и чаще всего предлагают проводить антибактериальную терапию в течение 4-6 недель после оперативного вмешательства. При этом используются препараты, к которым чувствительны микроорганизмы, полученные из культур крови и/или из окружающих протез тканей. Ключевым моментом в успешном лечении данного пациента был срок выполнения оперативного вмешательства. Без этого “стежка вовремя” (в оригинале – “stitch in time,” – часть английской пословицы: “A stitch in time saves nine” – “Один стежок, сделанный вовремя, отменяет необходимость в девяти позже”; прим. перев.) исход мог быть катастрофическим.
Оригинальный текст статьи:
Clinical Problem-Solving
A Stitch in Time
Christopher J. Graber, M.D., M.P.H., Adam S. Lauring, M.D., Ph.D., and Peter V. Chin-Hong, M.D.
N Engl J Med 2007; 357:1029-1034September 6, 2007
In this Journal feature, information about a real patient is presented in stages (boldface type) to an expert clinician, who responds to the information, sharing his or her reasoning with the reader (regular type). The authors' commentary follows.
A 64-year-old man with a history of coronary artery disease and peripheral vascular disease was admitted to the hospital with a several-month history of fevers, chills, and fatigue. These symptoms had begun soon after he had undergone percutaneous coronary intervention with placement of a stent in the left anterior descending coronary artery 10 months previously. He had initially been treated empirically by his physician with a 5-day course of ciprofloxacin, with temporary relief of symptoms. However, the symptoms returned 1 week after discontinuation of the antibiotic, and 3 weeks later he was admitted to a local hospital. Blood cultures obtained at that time were positive for group C streptococcus. A transthoracic echocardiogram was normal. Coronary angiography revealed stenosis of his left anterior descending coronary-artery stent, and another stent was inserted. After initial broad-spectrum antibiotic therapy, he was discharged with instructions to complete 6 weeks of therapy with ceftriaxone.
The patient's symptoms started shortly after he underwent catheterization. Although coronary-stent infection is extremely uncommon, I wonder whether an endovascular infection was introduced during the procedure. Optimal management at the patient's initial presentation would have been to obtain blood cultures before the initiation of treatment with ciprofloxacin. Group C streptococcus is a colonizer of the oral and gastrointestinal tract and an uncommon pathogen in humans, but it has been described as an etiologic agent of endocarditis, and it has been reported to cause a severe toxin-mediated sepsis syndrome akin to group A streptococcus. Given the suspicion of endovascular infection, I would have strongly considered transesophageal echocardiography, since it is more sensitive than transthoracic echocardiography for the detection of endocarditis.
After hospital discharge, the patient was asymptomatic during the remainder of the course of antibiotics. However, 1 month after finishing the antibiotics, he reported the recurrence of fatigue, malaise, and low-grade fever. During the next 7 weeks, he received empirical outpatient courses of trimethoprim–sulfamethoxazole, doxycycline, and cephalexin, none of which alleviated his symptoms. After the discontinuation of all antibiotics, Enterococcus faecalis was isolated from six different blood cultures over a 3-day period. The workup for the source of his bacteremia included transthoracic echocardiography, computed tomography (CT) of the abdomen and pelvis, duplex ultrasonography of the bilateral lower legs, an indium-labeled white-cell study, a barium small-bowel study, esophagoduodenoscopy, and colonoscopy. The results of these tests were unremarkable. He began to receive intravenous ampicillin at his local hospital for 4 to 6 weeks for the presumptive diagnosis of endocarditis, but he was discharged home while receiving vancomycin after 6 days, since he requested less frequent doses of antibiotics. His malaise and low-grade fever recurred while he was receiving vancomycin, and these symptoms were accompanied by increased dyspnea on exertion. He was readmitted to the hospital, the vancomycin was discontinued, and he was transferred to our referral hospital for further evaluation and management.
When the patient's symptoms recurred after discontinuation of ceftriaxone, a better approach would have been to recheck blood cultures before reinitiation of empirical therapy. E. faecalis is a gut commensal bacterium that is a frequent cause of endocarditis, and it can have an indolent course. The fact that multiple blood cultures obtained on multiple days were positive for the same organism suggests an endovascular source of infection. Especially given the previous positive cultures for group C streptococcus, an evaluation of the gastrointestinal tract is warranted. Transesophageal echocardiography is also indicated to better evaluate for endocarditis. The optimal treatment for an endovascular infection due to enterococcus includes both ampicillin and gentamicin, and I would initiate both antibiotics pending the results of susceptibility testing.
In addition to the stent placements in the left anterior descending artery 7 and 10 months before admission, the patient had undergone coronary-artery bypass grafting 20 years previously and angioplasty of the left anterior descending coronary artery 7 years previously. Seventeen months before admission, he underwent an aortobifemoral and femoral–popliteal bypass with stent placement in the right femoral artery. His other medical conditions included mild congestive heart failure, type 2 diabetes mellitus, hyperlipidemia, and gastroesophageal reflux. His medications included furosemide, insulin, glipizide, aspirin, pantoprazole, and simvastatin. His family history was notable for early-onset coronary artery disease in his father and brother. He was a current smoker with a 75 pack-year smoking history. He reported infrequent alcohol consumption.
The aortobifemoral bypass and femoral–popliteal bypass should be considered as endovascular sources of infection, since the workup performed to date does not rule them out. On physical examination, I would be looking for evidence of endovascular infection (Roth spots, mucosal petechiae, splinter hemorrhages, Osler's nodes, and Janeway's lesions), the distribution of which may provide clues to the location of the infection. For example, lesions on one or both legs without lesions on the arms would implicate a source below the heart, such as the aortic graft.
On physical examination, the temperature was 37.7°C; blood pressure, 157/57 mm Hg; pulse, 75 beats per minute; respirations, 16 breaths per minute; and oxygen saturation, 96% while breathing ambient air. The patient appeared to be uncomfortable but not in acute distress. The chest examination was notable for coarse breath sounds bilaterally and scant rales at both lung bases. The jugular venous pressure was 15 cm of water. The cardiovascular examination showed a normal rate and regular rhythm; there was an S3 and a grade 2/6 systolic crescendo–decrescendo murmur, heard best at the left sternal border. The abdomen was soft and not distended, and there was no tenderness on palpation. Examination of the arms and legs revealed a peripherally inserted central catheter placed in the right antecubital fossa; the site was nonerythematous and nontender. There was no edema of or petechiae on the legs.
The patient appears to have at least moderate congestive heart failure. Although there is little on physical examination to indicate endocarditis other than a systolic murmur that does not appear to be regurgitant on the basis of quality and location, there are signs of congestive heart failure, which might reflect valvular compromise from endocarditis. The patient's peripherally inserted central catheter may be a source of intercurrent infection, although the absence of erythema and tenderness at the entrance site makes line infection less likely.
A differential count was not performed. The white-cell count was 7400 per cubic millimeter, the hematocrit was 28.1% (mean corpuscular volume, 92 μm3), and the platelet count was 304,000 per cubic millimeter. No previous complete blood count was available for comparison. The blood urea nitrogen level was 16 mg per deciliter (5.7 mmol per liter); the creatinine level was 1.5 mg per deciliter (133 μmol per liter), and the erythrocyte sedimentation rate was 91 mm per hour. Electrolyte levels and liver-function tests were normal. The troponin I level was 0.35 μg per deciliter (normal value, <0.5), and the brain natriuretic peptide level was 1020 pg per milliliter (normal value, <73). The electrocardiogram showed a normal sinus rhythm and evidence of left ventricular hypertrophy. A urinalysis was normal. The chest radiograph showed mild cardiomegaly with clear lung fields.
The patient's anemia warrants further investigation, including iron studies to assess the possibility of gastrointestinal blood loss. It would also be helpful to examine a peripheral-blood smear for evidence of intravascular hemolysis, a finding that is more common in patients with prosthetic-valve endocarditis but that occurs in rare cases in patients with native-valve endocarditis. I would obtain at least two sets of blood cultures but would not start empirical antibiotics at this point, since the patient appears to be clinically stable.
The peripheral-blood smear was normal. Iron studies were not performed. Blood cultures were obtained. On the second day, treatment with piperacillin–tazobactam was initiated after gram-negative rods were isolated in the blood cultures obtained at the time of admission. The patient's therapy was switched to imipenem after he became febrile on day 3. Serial blood cultures were obtained before the administration of antibiotic therapy. On admission, one of two sets of cultures was positive for Enterobacter cloacae. On day 1, one of two sets was positive for Bacillus cereus, E. cloacae, and Staphylococcus epidermidis. On day 2, one of two sets was positive for E. cloacae and two of two sets were positive for E. faecalis.
All of the organisms isolated are gut commensals, suggesting communication between the patient's gastrointestinal tract and his bloodstream. The reappearance of E. faecalis in the blood cultures is further evidence that he may have had an incompletely treated endovascular infection 1 month previously. The combination of a strong suspicion of endovascular infection, the likely gastrointestinal source of bacteremia, and the patient's anemia should prompt evaluation of the patient's aortobifemoral bypass graft. I would also recommend removing his central venous catheter, since these organisms could also originate from an infected line.
The central venous catheter was removed; the semiquantitative culture of the tip was negative. The antibiotics were switched to vancomycin and piperacillin–tazobactam, to which all of the bacteria were susceptible. Surveillance blood cultures on day 3 of treatment with these antibiotics were negative. Transesophageal echocardiography showed normal ventricular function and a moderately calcific aortic valve with no major stenosis or regurgitation. The mitral, tricuspid, and pulmonary valves were normal, and there was no evidence of vegetation on any valve. A magnetic resonance angiogram (MRA) of the abdomen and leg was performed and showed a patent aortobifemoral bypass graft and right femoral–popliteal bypass graft with no evidence of perigraft abnormality.
The negative culture of the catheter tip argues against a catheter infection. The negative transesophageal echocardiography, a test with a high sensitivity for endocarditis, makes this diagnosis unlikely as well. It is also somewhat surprising that this patient, who presented with clinical congestive heart failure, had an essentially unremarkable echocardiogram. Although an MRA showing definitive evidence of graft infection would have clinched the diagnosis, the negative study does not rule out an aortoenteric fistula.
An indium-labeled white-cell whole-body study showed no findings to suggest focal active infection. Blood cultures on day 8 were positive for Candida albicans, and treatment with fluconazole was initiated. Physical examination revealed new, painful petechiae on the patient's right foot.
Fungemia often develops after broad-spectrum antibiotic therapy because bacterial eradication facilitates colonization and invasion by candida. Since candida species may also be part of the normal gastrointestinal flora, the isolation of an additional gut commensal bacteria from blood cultures again argues for communication between the gastrointestinal tract and the vasculature. The finding of painful petechiae on the right foot provides support for a focal, below-the-heart, graft-associated endovascular infection. I would urge the vascular surgeons to consider operative exploration.
CT of the abdomen showed no abscess or fluid collection surrounding the aortobifemoral graft. Repeated MRA showed no overt evidence of endovascular infection but did show a close association of the proximal aortobifemoral bypass graft with the terminal duodenum Figure 1
Magnetic Resonance Angiogram Showing the Close Association between the Aortic Graft and the Terminal Duodenum (Arrow).
(Figure 1Figure 1
Magnetic Resonance Angiogram Showing the Close Association between the Aortic Graft and the Terminal Duodenum (Arrow).). Four days later, the patient was taken to the operating
room for an exploratory laparotomy. A periprosthetic enteric fistula measuring 2 cm by 2 cm was found between the terminal duodenum and the proximal right limb of the aortobifemoral bypass graft (Figure Figure 2
