
- •Вопрос 32. Полициклические соединения (ряд нафталина, антрацена, фенантрена, флуорена, бифенила, пирена). Номенклатура, способы получения, физические и химические свойства.
- •Нафталин.
- •Антрацен.
- •Фенантрен
- •Флуорен
- •Бифенил
- •Вопрос 39.Меркаптаны, сульфиды, дисульфиды, тиофены, бензотиофены. Номенклатура, способы получения, физические и химические свойства.
Вопрос 39.Меркаптаны, сульфиды, дисульфиды, тиофены, бензотиофены. Номенклатура, способы получения, физические и химические свойства.
Меркаптаны (тиолы).
Общая формула меркаптанов:R-SH
Где R – алькильный радикал
Номенклатура.
На протяжении более 100 лет общепринятой для этого класса соединений была номенклатура, в основе которой лежит название «меркаптан». Однако в настрящее время существует стремление систематизировать сернистые соединения по другому принципу, и для соединений этого класса все чаще используют название соответствующего углеводорода с суффиксом «тиол».1 Например, С4H9SH – бутантиол (но не бутилтиол).
-
Формула
Тиол
Меркаптан
СH3SH
(СH3)2CHSH
(CH3)3CSH
С6H5SH
С6H11SH
Метантиол
Изопропантиол
Трет-Бутантиол
Бензолтиол
Циклогексантиол
Метилмеркаптан
Изопропилмеркаптан
Трет-Бутилмеркаптан
Тиофенол
Циклогексилмеркаптан
Физические свойства.
Меркаптаны содержатся в основном во фракциях, выкипающих до 300 С. Полярность связи S-H значительно ниже, чем полярность связи O-H, в результате водородные связи между молекулами тиолов значительно слабее, чем у спиртов, и вследствие этого их температура кипения ниже, чем у соответствующих спиртов.
Температуры кипения меркаптанов (тиолов).
Меркаптан (тиол) |
Температура кипения, С |
H2S CH3SH C2H5SH C6H5SH |
-61 6 37 168 |
|
|
Меркаптаны малорастворимы в воде, но хорошо растворяются в этаноле, эфире и других органических растворителях.
Такие меркаптаны, как сероводород (H2S), метилмеркаптан (CH3SH) и этилмеркаптан (CH3CH2SH) являются наиболее летучими, токсичными и дурно пахнущими соединениями. Это свойство используется для одорации бытового газа — добавка меркаптанов к газу позволяет обнаруживать утечки газа в помещениях.
Химические свойства меркаптанов.
По химическим свойствам меркаптаны, в отличие от спиртов, приближаются к слабым кислотам.2
1). При взаимодействии с щелочами образуют солеобразные соединения – тиоляты.
С2H5SH + NaOH = H2O + C2H5SNa
2). Окисление. Взаимодействие со слабыми окислителями происходит с образованием дисульфидов, с сильными – с образованием сульфокислот:
C2H5-SH + [O] = C2H5-S-S-C2H5 (диэтилдисульфид)
C2H5-SH + [O] = C2H5-SO3H (этансульфокислота)
3). Взаимодействие с непредельными соединениями по радикальному или нуклеофильному механизмам. Радикальный механизм: RSH + R ---- RS + RH
CH3-CH=CH2 + RS ---- CH3-CH-CH2SR -------- CH3-CH2-CH2SR + RS
Нуклеофильное присоединение:
CH3-CH=CH2 +RS ---- CH3-CHSR-CH2 -------- CH3-CHSR-CH3
Сульфиды (тиоэфиры).
Наибольшее содержание сульфидов наблюдается в средних дистиллятах (легроино-керосиновые фракции). С повышением температуры кипения фракций выше 300-350 С содержание сульфидов в них резко падает. Кроме линейных сульфидов в нефтях присутствуют циклические сульфиды (тиоцикланы). Во многих нефтях тиоцикланы составляют главную часть сульфидов.3 Общая формула:
R-S-R’
Номенклатура сульфидов (тиоэфиров).
В названиях тиоэфиров R–S–R’ упоминают не углеводороды, а соответствующие радикалы, связанные с S, добавляя суффикс «сульфид», например, С4H9SC2H5 – бутилэтилсульфид. Часто используют обобщенное название тиоэфиров – органические сульфиды. Допускается и составление названий тиоэфиров по правилам, применяемым в случае углеводородов – углеводородную цепь нумеруют с того конца, который ближе к атому S, при этом атом S также нумеруется, а его положение указывают с помощью числового индекса: С4H9SC2H5 – 3-тиагептан (корень «гептан» означает 7 атомов в цепи, включая S).
Если атом S входит в состав углеводородного цикла, то используют правила номенклатуры гетероциклических соединений. (C6H5SC6H5 - дифенилсульфид).
Физические свойства сульфидов (тиоэфиров).
Сульфиды – жидкости, кипящие при температуре, близкой к температуре кипения меркаптанов с той же молекулярной массой. Например, этилмеркаптан (С2H5SH) имеет температуру кипения 37 С, а диметилсульфид (CH3SCH3) – 38 С.
Сульфиды нерастворимы в воде и имеют эфирный запах
Химические свойства сульфидов (тиоэфиров).
По химическим свойствам являются веществами нейтральными.
1). Окисление с образованием сульфооксидов или сульфонов R2SO2 (в
зависимости от силы и количества окислителя):
2). Взаимодействие с алкилгалогенидами с образованием тиониевых (сульфониевых) солей:
Дисульфиды.
Дисульфиды обнаружены в лёгких и средних дистиллятах (керосино-газойлевые фракции). Дисульфиды – это соединения, содержащие в молекуле два связанных друг с другом атома серы.
Номенклатура дисульфидов.
Различают ациклические (R-S-S-R’), моноциклические и полициклические дисульфиды. Алифатические дисульфиды называют также дитиаалканами, моноциклические – дитиациклоалканами, полициклические – эпидитиациклоалканами. Наибольшее практическое значеие имеют дисульфиды первого типа.
Физические свойства дисульфидов.
Алифатические соединения этой группы – высокипящие, дурнопахнущие маслянистые жидкости, сильно преломляющие свет. Ароматические срединения являются кристаллами. Длина связи S-S около 0,2 нм, барьер вращения вокруг этой связи до 67 кДж/моль, угол CSS около 103. Энергия диссоциации дисульфидной связи около 293 кДж/моль, максимум поглощения – в области длин волн 245-325 нм. Частота валентных колебаний – в интервале 500-800 см-1.
Алифатические дисульфиды нерастворимы в воде, но хорошо растворяются в органических растворителях.
Химические свойства дисульфидов.
Химические свойства дисульфидов определяются низкой прочностью дисульфидной связи.
1). Взаимодействие с водородом с образованием меркаптанов:
С2H5-S-S-C2H5 + 2H = 2C2H5SH
2). Окисление пероксидами до сульфокислот RSO3H, сульфиновых кислот RSO2H.
3). Взаимодействие с сульфурилгалогенидами (общая формула - SO2Hal2):

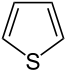
Тиофен
Тиофен – простейшее пятичленное гетероциклическое соединение с ароматическим характером.
Тиофен подобен бензолу. По физическим и химическим свойствам тиофен весьма сходен с бензолом, а производные тиофена близко стоят к соответственным производным бензола. Эти соединения распределены по всем нефтяным фракциям.
Физические свойства тиофенов.
Сам тиофен и его алкилзамещенные распределены во фракциях, выкипающих до 250 С, бензо- и дибензотиофены концентрируются в высококипящих фракциях(выше 300-350 С). Тиофен – бесцветная жидкость с запахом бензола. Молекулярная масса – 84,14 г/моль. Температура плавления равна -38,2 С, температура кипения - 84 С.
Тиофены хорошо растворимы в углеводородах и других органических растворителях, не растворимы в воде. Молекула тиофена плоская.
Гомологи тиофена – бесцветные жидкости, растворимые во многих органических растворителях.
Химические свойства тиофенов.
Тиофен обладает выраженными ароматическими свойствами. В некоторых реакциях тиофен значительно активнее бензола. Окисляется очень трудно.
1). Каталитическое присоединение водорода (с образованием тиофана):
2). Гидрирование тиофена в присутствии никеля, сопровождаемое десульфированием:
3). Галогенирование. Галогенирование тиофена приводит сначала к образованию 2-, а затем 2,5-замещенных. Возможно замещение всех атомов водорода.
4). Нитрирование:
5). Ацилирование (Замещение атомов водорода остатком карбоновой кислоты – ацильной группой RCO). При помощи ангидридов (два кислотных остатка, соединённых через атом кислорода) и хлорангидридов:
6). Взаимодействие с серной кислотой с образованием сульфокислоты – сульфурирование:
7). Реакция с хлорной ртутью: Реакция с хлорной ртутью:
Бензотиофен.
Физические свойства.
Молекулярная масса 134,2; бесцветные кристаллы. Существуют в виде двух изомеров - бензотиофена (ф-ла I) и бензотиофена (II). Для бензо [в] тиофена (тионафтена) температура плавления 31,34°С (пикрата 149°С), т. кип. 219,9°С, 103-105°С/20 мм рт. Ст
Бензо [с] тиофен (изобензотиофен) - вещество с сильным запахом нафталина; температура плавления 50-51 °С. Разлагается уже при — 30 °С в атмосфере N2. Нестабильность обусловлена повыш. электронной плотностью у углеродных атомов в положениях 1 и 3

Химические свойства.
Он хорошо растворим в органических растворителях, плохо-в воде.
Металлирование с помощью C4H9Li идет в положение 2. Электронодонорные заместители в положении 2 или 3 направляют замещение в соседнее положение, электроноакцепторные - в бензольное кольцо. Введение одной или двух алкоксигрупп в бензольное кольцо значительно облегчает ацилирование и направляет его в положение 2. При взаимодействие с Na в жидком NH3 образуется о-этилтиофенол, с никелем Ренея - этилбензол. Сильные алкилирующие средства алкилируют по S с образованием солей бензотиофения. Бензо [в] тиофены с группой NH2 во 2 или 3 положении мало устойчивы. Обычно их выделяют в виде солей или N-ацильных производных. 2- и 3-Гидрохсибензотиофены существуют только в виде оксопроизводных.
1 Клейманова И.И. Новейшие достижения нефтехимии и нефтепереработки.1962.—300 с.
2 Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия: Учебник для вузов/ Под ред. Петрова А.А. – 4-е изд., перераб. И доп.—М.: Высш. Школа, 1981.—592 с., ил.
3 Рябов В.Д. Химия нефти и газа: учебное пособие. – М.: ИД «ФОРУМ», 2009. – 336 с.
