
- •Естествознание в системе форм общественного сознания
- •3.Философия, математика, гуманитарные и естественные науки и их объекты
- •4. Естественнонаучная и гуманитарная культуры. Специфика и взаимосвязь естественнонаучного и гуманитарного типов культур
- •5. Проблема постнеклассического межкультурного диалога естественных и гуманитарных наук
- •8. Движение и его виды. Относительность движения
- •9. Законы сохранения и их роль в формировании научной картины мира
- •10. Пространство и время как основные свойства материи
- •§ 2. Термодинамические системы и их характеристики
- •13.Обратимые и необратимые процессы. Равновесное состояние и флуктуации. Закон возрастания энтропии
- •15. Бифуркации и аттракторы. Спонтанная самоорганизация в природе и обществе
- •17. Соотношение неопределенностей и квантово-волновой дуализм
- •18. Квантовая инженерия в наномире.
- •19. Современные представления о строении атома
- •20. Представление об элементарных частицах и их взаимодействии
- •21. Элементы современной космологии (физическая вселенная)
- •22. Химия как наука, современная химическая картина мира (структурные уровни организации материи с точки зрения химии)
- •23. Классификация химических веществ
- •24. Растворы и их особенности
- •25. Химическая идентификация
- •26. Химические процессы
- •27. Химия экстремальных состояний
- •28. Роль современной химии в экономике
- •29. Химические процессы и материалы
- •30. Химия и нанотехнологии
- •33. Биология как наука и особенности биологического познания мира
- •34. Фундаментальные и частные биологические теории
- •35. Традиционный, физико-химический, эволюционный и биоинженерный периоды развития биологии. Основные достижения биологии в эти периоды
- •41.Структурные уровни организации живой материи
- •53. Экологические параметры социального развития и глобальные проблемы современности
13.Обратимые и необратимые процессы. Равновесное состояние и флуктуации. Закон возрастания энтропии
9.10. Обратимые и необратимые процессы. Круговой процесс
Обратимым процессом называют такой процесс, который может быть проведен в обратном направлении таким образом, что система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности. Обратимым может быть только равновесный процесс.
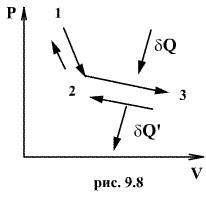
Обратимый процесс обладает следующими свойствами: если при прямом ходе на каком-то элементарном участке (рис. 9.8.) система получает тепло и совершает работу , то при обратном ходе на том же участке система отдает тепло и над ней совершается работа . По этой причине после протекания обратимого процесса в одном, а затем в обратном направлении и возвращение системы в первоначальное состояние в окружающих телах не должно оставаться никаких изменений. Например шарик на пружине в вакууме колеблется бесконечно долго.
В том случае, когда после завершения прямого и обратного процессов система вернулась в первоначальное состояние и в окружающей среде остались изменения, процесс является необратимым. Очевидно, что все процессы в природе необратимые.
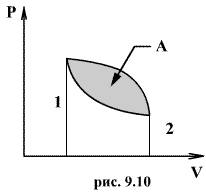
Круговым процессом (или циклом) называется такой процесс при котором система после ряда изменении возвращается в исходное состояние. На графике цикл изображается замкнутой кривой Работа совершаемая при круговом процессе, численно равна площади охватываемой кривой. После совершения цикла система возвращается в прежнее состояние. Поэтому всякая функция состояния, в частности внутренняя энергия, имеет в начале и в конце цикла одинаковое значение.
Примеры
Выпечка пирога — необратимый процесс. Гидролиз солей — обратимый процесс.
РАВНОВЕСНОЕ СОСТОЯНИЕ- состояние, в к-рое приходит термодинамич. система при постоянных внеш. условиях. Р. с. характеризуется постоянством во времени термодинамич. параметров и отсутствием в системе потоков вещества и энергии .
Флуктуации (от лат. fluctuatio – колебание), случайные отклонения наблюдаемых физических величин от их средних значений. Флуктуации происходят у любых величин, зависящих от случайных факторов и описываемых методами статистики
5.8. Равновесные флуктуации
Проведенное в предыдущих параграфах статистическое описание равновесных состояний термодинамической системы позволяет на основе функции распределения определять средние значения макроскопических параметров её состояния. Однако в любой, даже равновесной системе, существуют случайные отклонения от этих средних значений, которые можно экспериментально наблюдать при долговременных измерениях термодинамических параметров состояния системы. Так, в частности, если длительное время и с высокой точностью измерять температуру небольшого объема газа, то можно заметить, что она претерпевает небольшие случайные изменения даже в случае отсутствия внешних тепловых возмущений. На наличие случайных изменений давления указывает возникновение хаотического движения небольших частичек, помещенных в среду, называемое броуновским движением.
Указанные отклонения от средних значений термодинамических параметров состояния системы называются флуктуациями. Они возникают вследствие хаотического теплового движения частиц термодинамической системы. Мы будем рассматривать только флуктуации в равновесной системе, которые соответственно называются
Энтропия – это очень важное и ёмкое понятие в естественных науках. энтропия – это мера беспорядка, это мера необратимого рассеивания энергии (которое физики любят обзывать диссипацией). Чтобы лучше уяснить, о каком порядке и беспорядке идёт речь, поставим такой опыт. Насыпем в стеклянную банку чёрных и белых дробинок (на треть банки). Сперва насыпем чёрных, затем белых. Дробинки у нас располагаются как бы в два слоя: снизу чёрный, сверху белый. А затем несколько раз встряхнём эту банку. Что получится? Дробинки равномерно перемешаются. И сколько бы мы затем не трясли эту банку, нам вряд ли удастся добиться, чтобы дробинки снова расположились в два слоя. Вот она, энтропия в действии! Состояние, когда дробинки были расположены в два слоя, считается упорядоченным. Состояние, когда дробинки равномерно перемешаны, считается беспорядочным. Чтобы вернуться в упорядоченное состояние, нужна настоящая Золушка! Чтобы навести хаос в банке, почти не нужно усилий. Чтобы привести в порядок содержимое этой банки, нужны серьёзные усилия. И это фундаментальное свойство жизни. ЗАКОН ВОЗРАСТАНИЯ ЭНТРОПИИ.
И этот закон гласит:
ЭНТРОПИЯ ЗАМКНУТОЙ СИСТЕМЫ ВОЗРАСТАЕТ
Если вернуться к нашей банке с дробинками, то на её примере мы хорошо увидели возрастание энтропии, как меры беспорядка. Чем больше энтропия, тем больше беспорядка. Мы также увидели, что для того, чтобы снизить энтропию (беспорядок), надо приложить немало усилий.
Если мы не развиваемся, то мы деградируем. Закон возрастания энтропии неумолимо работает и в жизни человеческой Возьмём в качестве системы человека. Человеку ничего не надо делать, чтобы его энтропия возрастала, ведь она возрастает самопроизвольно, по закону природы. А вот, чтобы противостоять этому возрастанию, надо прилагать усилия. И чем больше усилий, тем больше порядка и осознанности входит в нашу жизнь.
А ещё важно не только количество усилий, но и их качество (читайте энергия). Можно произвести огромное количество действий, но так и не привести свои дела в порядок. Можно бесконечно долго пинать колёса и протирать стёкла автомобиля, который не заводится. А можно разобраться с реальной причиной поломки, испачкав руки в смазке.
А Вы обратили внимание на то, что в формулировке закона возрастания энтропии присутствует слово «замкнутый»?
Что такое замкнутая система? Это система, которая не обменивается энергией и информацией с внешней средой. И если внутри этой системы не производится работа по снижению энтропии, то вскоре в этой системе воцарится полный беспорядок. Обмениваясь информацией и энергией с окружающими нас системами (людьми), мы снижаем свою энтропию (свой внутренний беспорядок)!
Правда, это действительно, если энергия и информация, получаемая нами от других, не приводит к росту этого беспорядка. А это возможно, когда мы общаемся с людьми организованными, творческими, сильными. И не важно, как мы с ними общаемся, через книги, словами, через Интернет. Всё это каналы передачи информации и энергии. Впуская в себя позитивную информацию и энергию, мы повышаем свой внутренний порядок.
Итак, помните про закон возрастания энтропии и действуйте, поскольку Вам ничего не надо делать, чтобы воцарился хаос. Достаточно опустить руки, потерять веру в свои силы – и Вы попали в жернова закона возрастания энтропии.
14. Неравновесные системы и их характеристики.
неравновесные открытые системы-. Это такие системы, в которых неравновесное состояние поддерживается стационарно притоками энергии и вещества извне. В неравновесной термодинамике определяются условия, при которых энтропия открытых систем может убывать, что означает возрастание упорядоченности в таких системах, формирование в них новых структур.
В равновесной термодинамике рассматриваются системы, находящиеся в состоянии равновесия, и изучаются очень медленные (квазистатические, обратимые) процессы, протекающие через непрерывную последовательность равновесных состояний. В этих условиях переменные состояния, например давление и температура, при отсутствии внешних сил не зависят от пространственных координат. С типичным примером неравновесной системы мы встречаемся в обычных потоках газа, когда его плотность, гидродинамическая скорость и температура меняются от точки к точке. Существование градиентов этих параметров приводит к переносу массы, импульса и энергии. Возникающие процессы переноса стараются выровнять неоднородности в распределении плотности, скорости и температуры, приближая систему к равновесию. Процессы переноса характеризуются соответствующими потоками. Например, градиент температуры вызывает поток тепла, градиент плотности - поток массы и т.д. В общем случае говорят, что потоки вызываются обобщенными термодинамическими силами (градиенты температуры или концентрации - простейший пример термодинамических сил)
В неравновесных системах основные переменные состояния, такие как плотность, гидродинамическая скорость, температура, давление меняются во времени и в пространстве. В таких системах имеются градиенты плотности, температуры, давления, концентрации.
Законы термодинамики, утверждают, что изолированная, замкнутая система со временем приходит в положение равновесия. С молекулярно-кинетической точки зрения положению равновесия отвечает состояние максимального хаоса. При удалении от равновесия состояние становится все более неустойчивым, и даже малые изменения какого-либо параметра могут перевести систему в новое состояние. Поэтому при изучении образования новых структур от замкнутых систем следует перейти к рассмотрению систем открытых, которые могут обмениваться с окружающей средой веществом или энергией, т. е. неравновесным состояниям. Отличия неравновесной структуры от равновесной заключаются в следующем:
1.Система реагирует на внешние условия (гравитационное, электромагнитное поля и т. п.).
2.Поведение системы случайно и не зависит от начальных условий, т. е. не зависит от предыстории.
3.Приток энергии создает в системе порядок, и, стало быть, энтропия уменьшается.
4.Наличие в развитии системы бифуркации — переломной точки в развитии системы.
Когерентность — система ведет себя как единое целое, как если бы она была вместилищем дальнодействующих сил. Таким образом, различают области равновесности и неравновесности, в которых может пребывать система. Ее поведение при этом существенно меняется.
